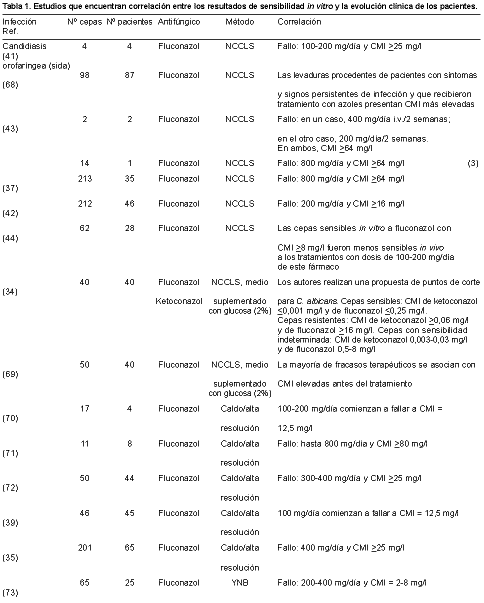
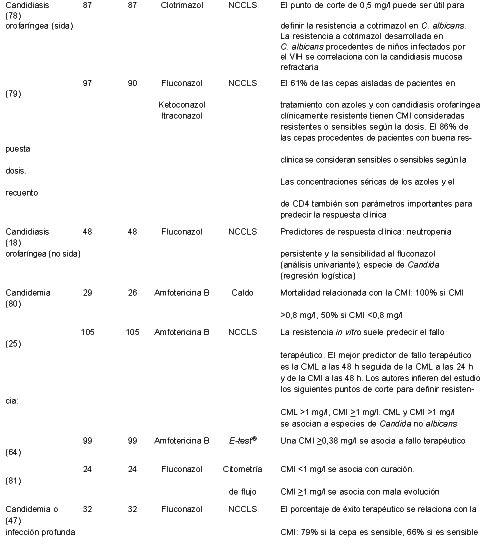
Correlación entre las pruebas de sensibilidad in vitro a los antifúngicos y la evolución clínica de los pacientes con candidiasis y criptococosisA. Viudes1, E. Cantón2, J. Pemán3, J.L. López-Ribot1 y M. Gobernado3 RESUMEN El aumento del número de infecciones fúngicas, así como la descripción de resistencias frente a los diversos antifúngicos, ha puesto de manifiesto la necesidad de realizar estudios de sensibilidad in vitro que sean útiles para predecir la evolución clínica de los pacientes con este tipo de infecciones. Recientemente, el National Committee for Clinical Laboratory Standards (NCCLS) aprobó un método de referencia para las pruebas de sensibilidad a los antifúngicos que reflejó en el documento M27-A. Este avance importante en la estandarización de las pruebas de sensibilidad in vitro ha permitido también comparar los resultados obtenidos en el laboratorio con la evolución de los pacientes. En este artículo se revisan los estudios de correlación de la sensibilidad in vitro con la evolución clínica de los pacientes con infecciones fúngicas. En general se puede predecir la evolución clínica, sobre todo en los pacientes infectados por el VIH con candidiasis orofaríngea tratados con fluconazol. Sin embargo, en otros grupos más heterogéneos de pacientes no es fácil relacionar la sensibilidad in vitro con la evolución clínica. Palabras clave: Antifúngicos - Sensibilidad in vitro - Correlación evolución - Amfotericina B - Fluconazol - Flucitosina - Levaduras Correlation between in vitro susceptibility to antifungal drugs and the clinical evolution of patients with candidiasis and cryptococcosisSUMMARY The increase in the incidence of fungal infections and the emergence of resistance call for the development of techniques for measuring in vitro antifungal susceptibility that are useful for predicting clinical outcome in patients suffering from these infections. In the past, the lack of standardized testing techniques led to poor intra- and interlaboratory reproducibility. Recently, the National Committee for Clinical Laboratory Standards (NCCLS) has developed a reference method for antifungal susceptibility testing, document M27A. This document is a necessary and important step towards the standardization of antifungal susceptibility testing, which has important implications in the analysis of clinical and microbiological data.This article provides a comprehensive review of studies correlating in vitro antifungal susceptibility testing and clinical outcome. In general, it is possible to predict the therapeutic outcome, especially in HIV-infected patients with oropharyngeal candidiasis treated with fluconazole. However, in other more heterogeneous groups of patients it is more difficult to correlate the in vitro and in vivo data. Key words: Correlation - Antifungal drug - In vitro susceptibility - Amphotericin B - Fluconazole - Flucytosine - Yeast INTRODUCCIÓN El incremento de las infecciones fúngicas oportunistas durante las últimas décadas, junto con la aparición de resistencias a los diversos antifúngicos disponibles, hacen necesario el uso de técnicas para determinar la sensibilidad in vitro que posibiliten la correlación de los datos obtenidos en el laboratorio con la evolución clínica de los pacientes (1, 2). La resistencia a los antifúngicos puede dividirse en dos categorías: in vitro (primaria o secundaria) y clínica. La resistencia in vitro primaria, también llamada intrínseca o innata, es la que presenta el microorganismo de forma natural, por ejemplo Candida krusei frente a fluconazol. La resistencia in vitro secundaria es la que aparece cuando un microorganismo inicialmente sensible se hace resistente. Esta última forma de resistencia aparece con frecuencia en los pacientes infectados por el VIH, con candidiasis orofaríngea y en tratamiento prolongado con fluconazol (3-5). La resistencia clínica es aquella que aparece cuando el fracaso del tratamiento antifúngico no se asocia con una disminución de la sensibilidad in vitro. Este tipo de resistencia puede deberse a varios factores, tanto relacionados con el paciente (estado inmunitario, presencia de catéteres intravasculares o prótesis infectadas) como con el antifúngico (farmacocinética, interacciones farmacológicas, etc.). Asimismo, habrá que tener en cuenta los factores relacionados con la propia virulencia del microorganismo que ocasiona la infección. Según Espinel-Ingroff (6), para que un caso de resistencia sea correctamente evaluado se debe disponer de un método de sensibilidad in vitro fiable y estandarizado, de una descripción del fracaso terapéutico (incluyendo dosis, concentraciones séricas alcanzadas y posibles interacciones con otros fármacos) y de una evaluación de los factores específicos del paciente. Una de las mayores dificultades para la evaluación de un caso de resistencia a los antifúngicos ha sido la falta de un método de determinación de la sensibilidad in vitro estandarizado. En el año 1997, el National Committee for Clinical Laboratory Standards (NCCLS) publicó un método de referencia para levaduras, el documento M27-A (7), en el cual se especifica el tamaño del inóculo y la forma de prepararlo, el medio de cultivo, la temperatura de incubación, y los tiempos y forma de lectura para amfotericina B, fluconazol, ketoconazol, itraconazol y flucitosina. Así mismo, establece los puntos de corte para fluconazol, itraconazol y flucitosina en Candida spp., tras 48 horas de incubación. La mayoría de estos datos están basados principalmente en la evolución clínica de la candidiasis orofaríngea en los pacientes con sida; sin embargo, incorpora pocos datos procedentes de pacientes con infección sistémica por levaduras (8, 9). Los diversos estudios multicéntricos que han utilizado el método propuesto por el NCCLS han demostrado que, siguiendo sus recomendaciones y controlando cuidadosamente las variables experimentales, se obtienen resultados reproducibles y comparables (10, 11). Sin embargo, según algunos autores, el método propuesto en el documento M27-A no es muy sensible para determinar la resistencia a la amfotericina B (12, 13), demostrando el método E-test® una mayor capacidad para la detección de aislamientos de Candida spp. resistentes a este antifúngico (14). Los estudios de correlación in vitro-in vivo se pueden realizar utilizando el modelo animal o el humano. El modelo animal tiene la ventaja de partir de grupos homogéneos y, por tanto, puede ser controlado más fácilmente que los ensayos clínicos en humanos. Sin embargo, tiene como inconveniente la dificultad para extrapolar las conclusiones obtenidas al modelo humano, debido, por ejemplo, a la diferente farmacología existente en ambos. En los humanos se puede estudiar a partir de dos tipos de infecciones, las cutaneomucosas y las profundas. Las primeras tienen la ventaja de la mayor frecuencia con que se producen, de presentar habitualmente un cuadro clínico uniforme, lo que facilita su diagnóstico, y de que un fracaso en el tratamiento no es tan grave como en el caso de las infecciones fúngicas profundas. Todos estos factores han contribuido a que éste sea el modelo más utilizado en los estudios de correlación. Sin embargo, este modelo presenta como limitaciones la dificultad de extrapolar los resultados a las infecciones fúngicas profundas, entre otras causas por la diferente farmacocinética y biodisponibilidad de los fármacos en la piel y en los órganos profundos, y por los defectos en las defensas de los pacientes, que suelen ser distintos en ambos casos. Finalmente, la evolución de los pacientes con infecciones fúngicas profundas es el modelo que más información proporciona. Sin embargo, presenta importantes limitaciones, como la dificultad en el diseño del estudio, la lentitud en la ejecución, la dificultad en el diagnóstico de estas infecciones, los factores dependientes del paciente (que pueden ser decisivos en la evolución clínica) y el hecho de que muchos pacientes se traten con más de un antifúngico, de forma simultánea o sucesivamente. Los principales estudios de la correlación entre la sensibilidad in vitro a los antifúngicos y la evolución clínica de las infecciones superficiales y profundas de los pacientes con candidiasis se resumen en las Tablas 1 y 2.
*El crecimiento lento o inexistente de C. neoformans en el medio RPMI 1640 propuesto por el NCCLS hizo que se cambiara por el medio YNB. La valoración de la importancia de las pruebas de sensibilidad resulta difícil debido a que los resultados in vitro no son los únicos que influyen en la evolución clínica. Factores dependientes del huésped como el estado inmunitario, factores dependientes del fármaco como su farmacocinética o las interacciones con otros fármacos y los factores de virulencia del microorganismo, son fundamentales en la evolución clínica (8, 9, 15-20). También debe tenerse en cuenta que en la evolución clínica no sólo influye el fármaco antifúngico administrado, sino que otras medidas terapéuticas, como el tratamiento eficaz de la enfermedad de base, la recuperación de la neutropenia o el recambio de los catéteres intravenosos suelen ser factores determinantes en el desenlace de una infección fúngica sistémica (8, 21, 22). La concentración mínima inhibitoria (CMI) no es un parámetro físico ni químico; por tanto, cualquier cambio en el tamaño del inóculo, el medio de cultivo, la temperatura y el tiempo de incubación, o en los puntos de corte, pueden hacer variar los resultados de la CMI, y de ahí la importancia de la estandarización de las pruebas de sensibilidad in vitro. Por otro lado, debido al gran número de factores que pueden influir en la evolución clínica de una infección fúngica, una CMI baja no predice necesariamente el éxito terapéutico; sin embargo, la resistencia in vitro es altamente indicativa de un fracaso terapéutico (6). Así mismo, diversos estudios sugieren que la concentración mínima fungicida (CMF) de la amfotericina B se correlaciona mejor que la CMI con la evolución clínica de los pacientes tratados con este antifúngico (23). Además, la aplicación de estudios de letalidad y farmacocinéticos, así como de otros parámetros (Cmáx/CMI, AUC/CMI, etc.), puede aportar una información muy útil para establecer la correlación entre la sensibilidad in vitro y la evolución de los pacientes con infecciones fúngicas (24, 25). FLUCONAZOL El método M27-A incluye los puntos de corte de fluconazol para Candida spp. (7) teniendo en cuenta que en las infecciones leves se suelen emplear dosis bajas (100 mg/ día), mientras que en las candidiasis invasoras se utilizan dosis más elevadas (400-800 mg/día). Los resultados de diversos estudios de correlación sugieren que cuando la CMI es >8 mg/l el aislamiento es sensible al fluconazol, mientras que si la CMI es >64 mg/l se le considera resistente. Finalmente, CMI entre 16 y 32 mg/l se consideran sensibles dependiendo de la dosis y parecen responder mejor a dosis elevadas de antifúngico (>400 mg/día) (7, 9, 18). Estas conclusiones presentan importantes limitaciones por el hecho de que la mayoría de los resultados se han obtenido de pacientes con candidiasis mucosa y, además, el concepto de sensibilidad dependiente de la dosis se ha demostrado claramente sólo en este grupo de infecciones. Por otro lado, debe tenerse en cuenta que la farmacocinética del fluconazol en los niños es diferente a la de los adultos, y ninguno de estos estudios se ha realizado en población pediátrica (26). La resistencia al fluconazol es infrecuente y en el género Candida aparece sobre todo en C. albicans, C. glabrata y C. krusei (27, 28). Maenza y cols. (29) han identificado, en pacientes con candidiasis orofaríngea, algunos factores de riesgo para el desarrollo de resistencia al fluconazol: número de episodios de candidiasis orofaríngea (3,1 vs. 1,8 en los controles), recuento de CD4 (11 vs. 71 células/ml), duración del tratamiento con antifúngicos (419 vs. 118 días) y uso sistémico de azoles (272 vs. 14 días). Algunos autores han comprobado que cuando los pacientes con candidiasis orofaríngea se tratan con pautas cortas de fluconazol se puede inducir la aparición de resistencias o seleccionar cepas resistentes. Cuando estos pacientes son estudiados de forma continuada en el tiempo, se comprueba que el incremento en la CMI se correlaciona con una disminución en la respuesta clínica a la dosis de fluconazol administrada (3). El uso frecuente de fluconazol como tratamiento de las infecciones fúngicas ha posibilitado el disponer de gran cantidad de información sobre las CMI de este antifúngico, determinadas por el método M27-A, y la evolución clínica de los pacientes con sida y candidiasis orofaríngea. Estos trabajos han sido revisados por diversos autores, que concluyen que la respuesta clínica de los pacientes con candidiasis orofaríngea se correlaciona con la sensibilidad in vitro (6, 9, 27). Sin embargo, existen pocos trabajos que estudien la correlación entre las CMI del fluconazol y la evolución de candidemias o candidiasis profundas; además, estos datos no aportan una prueba tan sólida como en el caso de la candidiasis orofaríngea. La revisión realizada por Espinel-Ingroff (6), que incluye 21 trabajos publicados después de 1991, aporta interesantes datos sobre la correlación entre la evolución clínica de los pacientes con infecciones por levaduras y las CMI de fluconazol e itraconazol. En ocho estudios (30-37), las CMI de fluconazol de 8 a >25 mg/l fueron definidas como resistentes, puesto que los pacientes no respondieron a dosis de fluconazol entre 50 y 400 mg/día. En otros trabajos se observaron CMI de fluconazol >64 mg/l; cinco de estos pacientes no respondieron con dosis de 100-200 mg/día y otros 17 tampoco lo hicieron con dosis de 400-800 mg/día (38-41). En una revisión realizada por Ghannoum y cols. (27) sobre siete trabajos (33, 36, 40-44) que siguen las normas del NCCLS para la realización del estudio de la sensibilidad, incluyendo más de 600 cepas aisladas de más de 150 pacientes con candidiasis orofaríngea, se concluye que para dosis de 100 mg/día de fluconazol los fracasos terapéuticos comienzan a aparecer cuando la CMI es de 8 mg/l, y son casi seguros cuando la CMI alcanza 16 mg/l. Así mismo, también indican que las dosis de 400 a 800 mg son con frecuencia eficaces aunque la CMI sea >64 mg/l. En otra amplia revisión (45) se concluye que las CMI del fluconazol se correlacionan con la evolución clínica en los pacientes con candidiasis orofaríngea asociada al sida; sin embargo, las CMI no son útiles para predecir la evolución clínica de los pacientes inmunodeprimidos no infectados por el VIH. En el primer caso, se atribuye la correlación a tres factores: 1) la candidiasis asociada al sida es muy frecuente y hace posible estudios a gran escala; 2) los pacientes afectados por el sida constituyen un grupo más homogéneo que el de los pacientes no infectados por el VIH y con candidiasis invasora; 3) la candidiasis orofaríngea en pacientes con sida es identificada y monitorizada fácilmente. La falta de correlación en el segundo caso se atribuye al limitado número de estudios realizados en pacientes inmunodeprimidos sin sida y a la heterogeneidad de los pacientes incluidos. Para determinar la importancia de las pruebas de sensibilidad in vitro en los pacientes sin sida, el autor de dicha revisión recomienda realizar nuevos estudios que incluyan grupos más homogéneos y que valoren adecuadamente los factores propios del huésped a la hora de realizar la correlación. Como ya se ha comentado anteriormente, los estudios de correlación entre la sensibilidad in vitro al fluconazol y la evolución clínica de los pacientes con candidiasis invasora son escasos. Rex y cols. (8) estudiaron la sensibilidad in vitro de 232 cepas de Candida procedentes de hemocultivo comparando el tratamiento con fluconazol (400 mg/día) con el de amfotericina B (0,5 mg/kg/día) en pacientes no neutropénicos con candidemia. Las CMI se determinaron por los métodos de microdilución y macrodilución siguiendo las recomendaciones del NCCLS. En este trabajo, las CMI elevadas no predijeron el fracaso terapéutico. En el caso del fluconazol se comprobó que, de 100 aislamientos procedentes de 64 pacientes tratados con fluconazol y con CMI <16 mg/l, 36 (procedentes de 19 pacientes) se asociaron con fracaso terapéutico. Además, las cuatro cepas con CMI >32 mg/l procedían de cuatro pacientes que respondieron al tratamiento con fluconazol. El análisis estadístico mediante regresión logística mostró una correlación inversa entre la evolución y la sensibilidad in vitro. Las CMI bajas se correlacionaron más con el fracaso en el tratamiento que con el éxito terapéutico, tanto para amfotericina B como para fluconazol. Algunos autores han criticado la metodología de este trabajo por incluir pacientes en quienes no se realizó el recambio de catéteres, pudiendo influir este hecho en el fracaso terapéutico (45). Recientemente, Lee y cols. (46) han estudiado la sensibilidad in vitro de 43 aislamientos de Candida spp. procedentes de pacientes no infectados por el VIH, y concluyen que las CMI obtenidas a las 48 horas mediante el método M27-A se correlacionan bien con la respuesta clínica de los pacientes con candidemia o infección profunda por Candida spp. tratados con 400 mg/día de fluconazol. Con respecto a Cryptococcus neoformans, los estudios de correlación entre las CMI de fluconazol y la evolución clínica se han realizado valorando pacientes VIH positivos con meningitis criptocócica; sin embargo, son escasos los que establecen el valor de las CMI como predictor de la respuesta al tratamiento, por lo que los puntos de corte no están disponibles para este microorganismo. El NCCLS propuso inicialmente el medio de cultivo RPMI 1640, pero debido al escaso crecimiento de C. neoformans en este medio recomendó su sustitución por el Yeast Nitrogen Base (YNB). Diversos autores han comparado los resultados obtenidos empleando los dos medios de cultivo. Así, Ghannoum y cols. (47) sugirieron que el medio YNB junto con un inóculo de 104 UFC/ml era más útil que el medio RPMI 1640 para correlacionar las CMI del fluconazol con la evolución clínica de los pacientes infectados por C. neoformans. Estas afirmaciones fueron corroboradas por varios estudios clínicos, como el de Witt y cols. (48) con 86 pacientes con sida y meningitis aguda por C. neoformans tratados con fluconazol solo o con flucitosina, llegando a la conclusión de que el éxito terapéutico se asocia con un hemocultivo negativo, CMI bajas de fluconazol (en medio YNB) y tratamiento asociado con flucitosina. Sin embargo, cuando se utiliza el medio RPMI 1640, las CMI no son capaces de predecir la evolución. Según los autores de este trabajo, el diferente crecimiento de C. neoformans en el medio RPMI 1640, recomendado por el NCCLS, y en el medio YNB podría influir en esta disparidad de los resultados. Así mismo, Jessup y cols. (49) comparan el método de microdilución, empleando el medio YNB y un inóculo de 104 UFC/ml, con el método recomendado por el NCCLS en 149 aislamientos de C. neoformans procedentes de 120 pacientes infectados por el VIH y con meningitis criptocócica, aunque finalmente sólo disponen de los datos clínicos de 35 de estos pacientes. Los autores concluyen que el método de microdilución empleando el medio YNB es una buena opción para estudiar la sensibilidad de C. neoformans al fluconazol, siendo el intervalo de las CMI mayor con este método que cuando se emplea el propuesto por el NCCLS. Por otra parte, Aller y cols. (50) estudian la sensibilidad de 28 aislamientos procedentes de 25 pacientes (24 con sida) con infecciones por C. neoformans con el método propuesto por el NCCLS, pero utilizando el medio YNB, y concluyen que la evolución clínica después del tratamiento mantenido con fluconazol es mejor cuando la CMI es <16 mg/l; las CMI >16 mg/l estuvieron siempre asociadas a fracaso terapéutico. Estos datos sugieren que los resultados de las pruebas de sensibilidad in vitro utilizando el medio YNB, junto con otros datos del paciente, pueden predecir la evolución clínica de la meningitis criptocócica. Sin embargo, es necesario continuar con estos estudios para llegar a establecer los puntos de corte adecuados que se correlacionen con la evolución clínica. ITRACONAZOL El NCCLS ha establecido los puntos de corte para itraconazol sólo en el caso de la candidiasis mucosa. Una cepa se considera sensible si la CMI de itraconazol es <0,125 mg/l, mientras que si es >1 mg/l se considera resistente. Los aislamientos con CMI entre estas cifras se consideran sensibles dependiendo de la dosis. Al contrario de lo que ocurre con el fluconazol, existen pocos trabajos que estudien la relación entre las CMI de itraconazol y la evolución clínica de los pacientes con infecciones fúngicas (9, 27, 41, 51-53). En la revisión realizada por Pfaller y cols. (17) se comprueba que la mayoría de las cepas de Candida spp. son sensibles al itraconazol: más del 90% de los aislamientos se inhiben con <1 mg/l y entre el 50% y el 70% con <0,12 mg/l. Algunos trabajos sugieren que el itraconazol puede ser efectivo en pacientes con sida que no responden al fluconazol (34, 54, 55). Sin embargo, el hecho de que las CMI de itraconazol para estas cepas sean elevadas (0,5-1 mg/l) sugiere que serían necesarias dosis altas de este fármaco para conseguir una respuesta clínica (54, 56-58). Además, muchos de estos pacientes tienen recaídas por cepas resistentes al fluconazol y con resistencia cruzada tanto al itraconazol como a otros azoles. Debe tenerse en cuenta que la biodisponibilidad del itraconazol es impredecible. Según el estudio de Cartledge y cols. (51), en ocho de los once casos que no respondieron al tratamiento con itraconazol a pesar de estar infectados por cepas sensibles in vitro a este antifúngico, el fracaso terapéutico se atribuyó a una deficiente absorción del fármaco. AMFOTERICINA B La mayoría de las cepas de Candida spp. resistentes in vitro a la amfotericina B (CMI >1 mg/l) proceden de pacientes inmunodeprimidos en tratamiento con antibióticos poliénicos, y se han asociado a una mala evolución clínica (59-61). En la mayoría de los casos, los aislamientos son inicialmente sensibles a la amfotericina B y desarrollan la resistencia durante el tratamiento. El método recomendado por el NCCLS para realizar las pruebas de sensibilidad a la amfotericina B no discrimina bien entre cepas resistentes y sensibles, ya que el intervalo de las CMI para la mayoría de los aislamientos es muy estrecho: 3-4 diluciones (62). Debido a estas limitaciones, los puntos de corte para la amfotericina B aún no están bien establecidos, pero la resistencia clínica se asocia a CMI >1 mg/l (6). En el trabajo realizado por Rex y cols. (8), el intervalo de las CMI para las cepas de Candida spp. procedentes de pacientes con candidemia está comprendido entre 0,125 y 1 mg/l, lo cual dificulta la detección de resistencia a la amfotericina B. Este mismo autor considera el uso del Antibiotic Medium nº 3 (AM#3) o la realización de pruebas basadas en la difusión en agar (E-test®) como alternativas al documento M27-A para detectar cepas de Candida y C. neoformans resistentes a la amfotericina B (13). Recientemente también se ha propuesto el medio Isosensitest para tal fin (63). A diferencia del fluconazol, en el caso de la amfotericina B la información disponible sobre la correlación entre la sensibilidad in vitro y la evolución clínica es escasa. Rex y cols. (8) no encuentran correlación entre las CMI de la amfotericina B y la evolución clínica de los pacientes con candidemia, y paradójicamente observan más fracasos terapéuticos en pacientes infectados por cepas con CMI más bajas, al igual que ocurría con el fluconazol (ya han sido comentadas previamente las limitaciones de este estudio). En un trabajo realizado por Nguyen y cols. (23) con 105 pacientes con candidemia y tratados con amfotericina B, los autores encuentran que la CMF predice mejor el fracaso terapéutico que la CMI (ambos parámetros se determinaron utilizando AM#3 y lecturas de la CMI a las 48 horas de incubación), y sugieren que las cepas inhibidas por concentraciones de amfotericina B >1 mg/l o con CMF >2 mg/l deben considerarse resistentes. En cambio, Clancy y cols. (80), determinando las CMI de amfotericina B mediante E-test® en 99 cepas de 99 pacientes con candidemia, encuentran que las candidemias producidas por las cepas que se inhiben con >0,38 mg/l tienen una elevada probabilidad de fracaso terapéutico. FLUCITOSINA Debido a la rápida aparición de resistencias cuando la flucitosina se emplea en monoterapia en el tratamiento de las infecciones por levaduras, este fármaco se suele emplear en asociación con otros antifúngicos, y por ello no se dispone de información sobre la correlación entre la sensibilidad in vitro y la evolución clínica de los pacientes tratados únicamente con flucitosina. Sin embargo, el NCCLS propone unos puntos de corte basándose en estudios farmacocinéticos y en modelos animales (7, 66, 67). Según estos estudios, con CMI <4 mg/l los microorganismos se consideran sensibles, con CMI >16 mg/l resistentes, y entre estos valores intermedias. CONCLUSIONES Los datos de la sensibilidad in vitro pueden predecir la evolución clínica en determinadas situaciones, como es el caso de los pacientes infectados por el VIH con candidiasis orofaríngea y en tratamiento con fluconazol. Sin embargo, en otros grupos más heterogéneos de pacientes no es fácil relacionar la sensibilidad in vitro con la evolución clínica. Además, para que los resultados de las pruebas de sensibilidad in vitro sean útiles en la predicción de la respuesta clínica, deben considerarse otros parámetros tales como el tratamiento antifúngico previo y actual (dosis, duración, vía de administración, grado de cumplimiento), el estado del paciente (enfermedad de base, recuento de CD4 y otros factores de riesgo) y los datos farmacocinéticos que aseguren la adecuada absorción y distribución del fármaco. Las pruebas de sensibilidad antes y después del tratamiento pueden ayudar también en el estudio de la correlación; además, los resultados de las pruebas de sensibilidad permiten distinguir el fracaso terapéutico debido a la resistencia microbiana del producido por otras causas inherentes al paciente, como incumplimiento del tratamiento, interacciones farmacológicas, y otras. Debe tenerse en cuenta que la identificación completa de los hongos invasores patógenos es una información muy valiosa ya que, en muchos casos, conocer la especie de Candida permite predecir, en gran medida, su sensibilidad antifúngica. Lo mismo ocurre con los hongos filamentosos, en los cuales la identificación de su género y especie es con frecuencia la única herramienta que puede ayudarnos para iniciar el tratamiento antifúngico y predecir la evolución. Los esfuerzos futuros se deben dirigir a establecer y validar los puntos de corte para todos los antifúngicos disponibles en la actualidad. Así mismo, en el caso de la amfotericina B es fundamental disponer de un método que identifique claramente los aislamientos resistentes a este antifúngico. AGRADECIMIENTOS Angel Viudes agradece a la Sociedad Española de Quimioterapia la concesión de una beca para realizar una estancia en Department of Medicine, Division of Infectious Diseases, The University of Texas, Health Science Center at San Antonio, Texas, U.S.A. BIBLIOGRAFÍA 1. Pfaller, M., Wenzel, R. Impact of the changing epidemiology of fungal infections in the 1990s. Eur J Clin Microbiol Infect Dis 1992; 11: 287-291. 2. Beck-Sague, C., Jarvis, W. R. Secular trends in the epidemiology of nosocomial fungal infections in the United States, 1980-1990. National Nosocomial Infections Surveillance System. J Infect Dis 1993; 167: 1247-1251. 3. Redding, S., Smith, J., Farinacci, G. y cols. Resistance of Candida albicans to fluconazole during treatment of oropharyngeal candidiasis in a patient with AIDS: Documentation by in vitro susceptibility testing and DNA subtype analysis. Clin Infect Dis 1994; 18: 240-242. 4. Johnson, E.M., Warnock, D.W., Luker, J., Porter, S.R., Scully, C. Emergence of azole drug resistance in Candida species from HIV-infected patients receiving prolonged fluconazole therapy for oral candidiasis. J Antimicrob Chemother 1995; 35: 103-114. 5. Revankar, S.G., Kirkpatrick, W.R., McAtee, R.K. y cols. Detection and significance of fluconazole resistance in oropharyngeal candidiasis in human immunodeficiency virus-infected patients. J Infect Dis 1996; 174: 821-827. 6. Espinel-Ingroff, A. Clinical relevance of antifungal resistance. Infect Dis Clin North Am 1997; 11: 929-944. 7. National Committee for Clinical Laboratory Standards. Reference method for broth dilution antifungal susceptibility testing of yeasts. Aproved standard M27A. National Committee for Clinical Laboratory Stanndards, Vilanova, Pa 1997. 8. Rex, J.H., Pfaller, M.A., Barry, A.L., Nelson, P.W., Webb, C. D. Antifungal susceptibility testing of isolates from a randomized, multicenter trial of fluconazole versus amphotericin B as treatment of nonneutropenic patients with candidemia. NIAID Mycoses Study Group and the Candidemia Study Group. Antimicrob Agents Chemother 1995; 39: 40-44. 9. Rex, J.H., Pfaller, M.A., Galgiani, J.N. y cols. Development of interpretive breakpoints for antifungal susceptibility testing: Conceptual framework and analysis of in vitro-in vivo correlation data for fluconazole, itraconazole, and candida infections. Subcommittee on Antifungal Susceptibility Testing of the National Committee for Clinical Laboratory Standards. Clin Infect Dis 1997; 24: 235-247. 10. Pfaller, M.A., Bale, M., Buschelman, B. y cols. Quality control guidelines for National Committee for Clinical Laboratory Standards recommended broth macrodilution testing of amphotericin B, fluconazole, and flucytosine. J Clin Microbiol 1995; 33: 1104-1107. 11. Rex, J.H., Pfaller, M.A., Lancaster, M., Odds, F.C., Bolmstrom, A., Rinaldi, M.G. Quality control guidelines for National Committee for Clinical Laboratory Standards Recommended broth macrodilution testing of ketoconazole and itraconazole. J Clin Microbiol 1996; 34: 816-817. 12. Espinel-Ingroff, A., Warnock, D.W., Vazquez, J.A., Arthington-Skaggs, B.A. In vitro antifungal susceptibility methods and clinical implications of antifungal resistance. Med Mycol 2000; 38 (Suppl. 1): 293-304. 13. Rex, J.H., Cooper, C.R. Jr., Merz, W.G., Galgiani, J.N., Anaissie, E.J. Detection of amphotericin B-resistant Candida isolates in a broth-based system. Antimicrob Agents Chemother 1995; 39: 906-909. 14. Wanger, A., Mills, K., Nelson, P.W., Rex, J.H. Comparison of E-test and National Committee for Clinical Laboratory Standards broth macrodilution method for antifungal susceptibility testing: Enhanced ability to detect amphotericin B-resistant Candida isolates. Antimicrob Agents Chemother 1995; 39: 2520-2522. 15. Ghannoum, M.A. Susceptibility testing of fungi and correlation with clinical outcome. J Chemother 1997; 9 (Suppl. 1): 19-24. 16. Arikan, S., Akova, M., Hayran, M., Ozdemir, O., Erman, M., Gur, D., Unal, S. Correlation of in vitro fluconazole susceptibility with clinical outcome for severely ill patients with oropharyngeal candidiasis. Clin Infect Dis 1998; 26: 903-908. 17. Pfaller, M.A., Rex, J.H., Rinaldi, M.G. Antifungal susceptibility testing: Technical advances and potential clinical applications. Clin Infect Dis 1997; 24: 776-784. 18. Voss, A., de Pauw, B.E. High-dose fluconazole therapy in patients with severe fungal infections. Eur J Clin Microbiol Infect Dis 1999; 18: 165-174. 19. Viudes, A., Pemán, J., Cantón, E., Úbeda, P., Gobernado, M. Actualización de las asociaciones de los antifúngicos sistémicos. Rev Esp Quimioterap 1999; 12: 107-115. 20. Viudes, A., Pemán, J., Cantón, E., López-Ribot, J., Gobernado, M. Actividad de las asociaciones de los antifúngicos sistémicos. Rev Esp Quimioterap 2001; 14: 30-39. 21. Uzun, O., Ascioglu, S., Anaissie, E.J., Rex, J.H. Risk factors and predictors of outcome in patients with cancer and breakthrough candidemia. Clin Infect Dis 2001; 32: 1713-1717. 22. Luzzati, R., Amalfitano, G., Lazzarini, L. y cols. Nosocomial candidemia in non-neutropenic patients at an Italian tertiary care hospital. Eur J Clin Microbiol Infect Dis 2000; 19: 602-607. 23. Nguyen, M.H., Clancy, C.J., Yu, V.L. y cols. Do in vitro susceptibility data predict the microbiologic response to amphotericin B? Results of a prospective study of patients with Candida fungemia. J Infect Dis 1998; 177: 425-430. 24. Andes, D., van Ogtrop, H. Characterization and quantition of the pharmacodynamics of fluconazole in a neutropenic murine disseminated candidiasis infection model. Antimicrob Agents Chemother 1999; 43: 2116-2120. 25. Rodero, L. Córdoba, S., Cahn, P. y cols. Timed-killing curves for Cryptococcus neoformans isolated from patients with AIDS. Med Mycology 2000; 38: 201-207. 26. Brammer, K.W., Coates, P.E. Pharmacokinetics of fluconazole in pediatric patients. Eur J Clin Microbiol Infect Dis 1994; 13: 325-329. 27. Ghannoum, M.A., Rex, J.H., Galgiani, J.N. Susceptibility testing of fungi: Current status of correlation of in vitro data with clinical outcome. J Clin Microbiol 1996; 34: 489-495. 28. Rex, J.H., Rinaldi, M.G., Pfaller, M.A. Resistance of Candida species to fluconazole. Antimicrob Agents Chemother 1995; 39: 1-8. 29. Maenza, J.R., Keruly, J.C., Moore, R.D., Chaisson, R.E., Merz, W.G., Gallant, J.E. Risk factors for fluconazole-resistant candidiasis in human immunodeficiency virus-infected patients. J Infect Dis 1996; 173: 219-225. 30. Cartledge, J.D., Midgley, J., Gazzard, B.G. Itraconazole cyclodextrin solution: The role of in vitro susceptibility testing in predicting successful treatment of HIV-related fluconazole-resistant and fluconazole-susceptible oral candidiasis. Aids 1997; 11: 163-168. 31. Lacassin, F., Damond, F., Chochillon, C. y cols. Response to fluconazole by 23 patients with human immunodeficiency virus infection and oral candidiasis: Pharmacological and mycological factors. Antimicrob Agents Chemother 1996; 40: 1961-1963. 32. Menichetti, F., Fiorio, M., Tosti, A. y cols. High-dose fluconazole therapy for cryptococcal meningitis in patients with AIDS. Clin Infect Dis 1996; 22: 838-840. 33. Rodríguez-Tudela, J.L., Martínez-Suarez, J.V., Dronda, F., Laguna, F., Chaves, F., Valencia, E. Correlation of in-vitro susceptibility test results with clinical response: A study of azole therapy in AIDS patients. J Antimicrob Chemother 1995; 35: 793-804. 34. Ruhnke, M., Eigler, A., Tennagen, I., Geiseler, B., Engelmann, E., Trautmann, M. Emergence of fluconazole-resistant strains of Candida albicans in patients with recurrent oropharyngeal candidiasis and human immunodeficiency virus infection. J Clin Microbiol 1994; 32: 2092-2098. 35. Ruhnke, M., Schmidt-Westhausen, A., Engelmann, E., Trautmann, M. Comparative evaluation of three antifungal susceptibility test methods for Candida albicans isolates and correlation with response to fluconazole therapy. J Clin Microbiol 1996; 34: 3208-3211. 36. Sangeorzan, J.A., Bradley, S.F., He, X. y cols. Epidemiology of oral candidiasis in HIV-infected patients: Colonization, infection, treatment, and emergence of fluconazole resistance. Am J Med 1994; 97: 339-346. 37. Willocks, L., Leen, C.L., Brettle, R.P., Urquhart, D., Russell, T.B., Milne, L.J. Fluconazole resistance in AIDS patients. J Antimicrob Chemother 1991; 28: 937-939. 38. Baily, G.G., Perry, F.M., Denning, D.W., Mandal, B.K. Fluconazole-resistant candidiasis in an HIV cohort. Aids 1994; 8: 787-792. 39. Berenguer, J., Díaz-Guerra, T.M., Ruiz-Díez, B., Bernaldo de Quirós, J.C., Rodríguez-Tudela, J.L., Martínez-Suárez, J.V. Genetic dissimilarity of two fluconazole-resistant Candida albicans strains causing meningitis and oral candidiasis in the same AIDS patient. J Clin Microbiol 1996; 34: 1542-1545. 40. Boken, D.J., Swindells, S., Rinaldi, M.G. Fluconazole-resistant Candida albicans. Clin Infect Dis 1993; 17: 1018-1021. 41. He, X., Tiballi, R.N., Zarins, L.T., Bradley, S.F., Sangeorzan, J.A., Kauffman, C.A. Azole resistance in oropharyngeal Candida albicans strains isolated from patients infected with human immunodeficiency virus. Antimicrob Agents Chemother 1994; 38: 2495-2497. 42. Heinic, G.S., Stevens, D.A., Greenspan, D. y cols. Fluconazole-resistant Candida in AIDS patients. Report of two cases. Oral Surg Oral Med Oral Pathol 1993; 76: 711-715. 43. Barchiesi, F., Hollis, R.J., McGough, D.A., Scalise, G., Rinaldi, M.G., Pfaller, M.A. DNA subtypes and fluconazole susceptibilities of Candida albicans isolates from the oral cavities of patients with AIDS. Clin Infect Dis 1995; 20: 634-640. 44. Pfaller, M.A., Rhine-Chalberg, J., Redding, S.W. y cols. Variations in fluconazole susceptibility and electrophoretic karyotype among oral isolates of Candida albicans from patients with AIDS and oral candidiasis. J Clin Microbiol 1994; 32: 59-64. 45. Ghannoum, M.A. Is antifungal susceptibility testing useful in guiding fluconazole therapy? Clin Infect Dis 1996; 22 (Suppl. 2): S161-S165. 46. Lee, S.C., Fung, C.P., Huang, J.S. y cols. Clinical correlates of antifungal macrodilution susceptibility test results for non-AIDS patients with severe Candida infections treated with fluconazole. Antimicrob Agents Chemother 2000; 44: 2715-2718. 47. Ghannoum, M.A., Ibrahim, A.S., Fu, Y., Shafiq, M.C., Edwards, J.E. Jr., Criddle, R.S. Susceptibility testing of Cryptococcus neoformans: A microdilution technique. J Clin Microbiol 1992; 30: 2881-2886. 48. Witt, M.D., Lewis, R.J., Larsen, R.A. y cols. Identification of patients with acute AIDS-associated cryptococcal meningitis who can be effectively treated with fluconazole: The role of antifungal susceptibility testing. Clin Infect Dis 1996; 22: 322-328. 49. Jessup, C.J., Pfaller, M.A., Messer, S.A., y cols. Fluconazole susceptibility testing of Cryptococcus neoformans: Comparison of two broth microdilution methods and clinical correlates among isolates from Ugandan AIDS patients. J Clin Microbiol 1998; 36: 2874-2876. 50. Aller, A.I., Martín-Mazuelos, E., Lozano, F. y cols. Correlation of fluconazole MIC with clinical outcome in cryptococcal infection. Antimicrob Agents Chemother 2000; 44: 1544-1548. 51. Cartledge, J.D., Midgley, J., Petrou, M., Shanson, D., Gazzard, B.G. Unresponsive HIV-related oro-oesophageal candidiasis An evaluation of two new in-vitro azole susceptibility tests. J Antimicrob Chemother 1997; 40: 517-523. 52. Le Guennec, R., Reynes, J., Mallie, M., Pujol, C., Janbon, F., Bastide, J.M. Fluconazole- and itraconazole-resistant Candida albicans strains from AIDS patients: Multilocus enzyme electrophoresis analysis and antifungal susceptibilities. J Clin Microbiol 1995; 33: 2732-2737. 53. Saag, M.S., Fessel, W.J., Kaufman, C.A. y cols. Treatment of fluconazole-refractory oropharyngeal candidiasis with itraconazole oral solution in HIV-positive patients. AIDS Res Hum Retroviruses 1999; 15: 1413-1417. 54. Johnson, E.M., Warnock, D.W. Azole drug resistance in yeasts. J Antimicrob Chemother 1995; 36: 751-755. 55. Cartledge, J.D., Midgley, J., Youle, M., Gazzard, B.G. Itraconazole cyclodextrin solution Effective treatment for HIV-related candidiasis unresponsive to other azole therapy. J Antimicrob Chemother 1994; 33: 1071-1073. 56. Barchiesi, F., Colombo, A.L., McGough, D.A., Fothergill, A. W., Rinaldi, M.G. In vitro activity of itraconazole against fluconazole-susceptible and -resistant Candida albicans isolates from oral cavities of patients infected with human immunodeficiency virus. Antimicrob Agents Chemother 1994; 38: 1530-1533. 57. Johnson, E.M., Davey, K.G., Szekely, A., Warnock, D.W. Itraconazole susceptibilities of fluconazole susceptible and resistant isolates of five Candida species. J Antimicrob Chemother 1995; 36: 787-793. 58. Martínez-Suarez, J.V., Rodríguez-Tudela, J.L. Patterns of in vitro activity of itraconazole and imidazole antifungal agents against Candida albicans with decreased susceptibility to fluconazole from Spain. Antimicrob Agents Chemother 1995; 39: 1512-1516. 59. Drutz, D.J., Lehrer, R.I. Development of amphotericin B-resistant Candida tropicalis in a patient with defective leukocyte function. Am J Med Sci 1978; 276: 77-92. 60. Pappagianis, D., Collins, M.S., Hector, R., Remington, J. Development of resistance to amphotericin B in Candida lusitaniae infecting a human. Antimicrob Agents Chemother 1979; 16: 123-126. 61. Merz, W.G., Sandford, G.R. Isolation and characterization of a polyene-resistant variant of Candida tropicalis. J Clin Microbiol 1979; 9: 677-680. 62. Rex, J.H., Pfaller, M.A., Rinaldi, M.G., Polak, A., Galgiani, J.N. Antifungal susceptibility testing. Clin Microbiol Rev 1993; 6: 367-381. 63. Cuenca-Estrella, M., Díaz-Guerra, M.T., Mellado, E., Rodríguez-Tudela, J.L. Detection of resistance to amphotericin B in Candida isolates by using Iso-sensitest broth. Antimicrob Agents Chemother 2001; 45: 2070-2074. 64. Nguyen, M.H., Peacock, J.E. Jr. Therapeutic approaches in patients with candidemia. Evaluation in a multicenter, prospective, observational study. Arch Intern Med 1995; 155: 2429-2435. 65. Stiller, R.L., Bennett, J.E., Scholer, H.J., Wall, M., Polak, A., Stevens, D.A. Correlation of in vitro susceptibility test results with in vivo response: Flucytosine therapy in a systemic candidiasis model. J Infect Dis 1983; 147: 1070-1077. 66. Dixon, D.M., Polak, A. In vitro and in vivo drug studies with three agents of central nervous system phaeohyphomycosis. Chemotherapy 1987; 33: 129-140. 67. Cameron, M.L., Schell, W.A., Bruch, S., Bartlett, J.A., Waskin, H.A., Perfect, J.R. Correlation of in vitro fluconazole resistance of Candida isolates in relation to therapy and symptoms of individuals seropositive for human immunodeficiency virus type 1. Antimicrob Agents Chemother 1993; 37: 2449-2453. 68. Quereda, C., Polanco, A.M., Giner, C. y cols. Correlation between in vitro resistance to fluconazole and clinical outcome of oropharyngeal candidiasis in HIV-infected patients. Eur J Clin Microbiol Infect Dis 1996; 15: 30-37. 69. Bart-Delabesse, E., Boiron, P., Carlotti, A., Dupont, B. Candida albicans genotyping in studies with patients with AIDS developing resistance to fluconazole. J Clin Microbiol 1993; 31: 2933-2937. 70. Newman, S.L., Flanigan, T.P., Fisher, A., Rinaldi, M.G., Stein, M., Vigilante, K. Clinically significant mucosal candidiasis resistant to fluconazole treatment in patients with AIDS. Clin Infect Dis 1994; 19: 684-686. 71. Ruhnke, M., Eigler, A., Engelmann, E., Geiseler, B., Trautmann, M. Correlation between antifungal susceptibility testing of Candida isolates from patients with HIV infection and clinical results after treatment with fluconazole. Infection 1994; 22: 132-136. 72. Troillet, N., Durussel, C., Bille, J., Glauser, M.P., Chave, J.P. Correlation between in vitro susceptibility of Candida albicans and fluconazole-resistant oropharyngeal candidiasis in HIV-infected patients. Eur J Clin Microbiol Infect Dis 1993; 12: 911-915. 73. Reynes, J., Mallie, M., Andre, D., Janbon, F., Bastide, J.M. [Treatment and secondary prophylaxis with fluconazole for oropharyngeal candidiasis in HIV-positive patients. A mycological analysis of failures]. Pathol Biol (Paris) 1992; 40: 513-517. 74. Sandven, P., Bjorneklett, A., Maeland, A. Susceptibilities of Norwegian Candida albicans strains to fluconazole: Emergence of resistance. The Norwegian Yeast Study Group. Antimicrob Agents Chemother 1993; 37: 2443-2448. 75. Dannaoui, E., Colin, S., Pichot, J., Piens, M.A. Evaluation of the E-test for fluconazole susceptibility testing of Candida albicans isolates from oropharyngeal candidiasis. Eur J Clin Microbiol Infect Dis 1997; 16: 228-232. 76. Revankar, S.G., Dib, O.P., Kirkpatrick, W.R. y cols. Clinical evaluation and microbiology of oropharyngeal infection due to fluconazole-resistant Candida in human immunodeficiency virus-infected patients. Clin Infect Dis 1998; 26: 960-963. 77. Pelletier, R., Peter, J., Antin, C., González, C., Wood, L., Walsh, T.J. Emergence of resistance of Candida albicans to clotrimazole in human immunodeficiency virus-infected children: In vitro and clinical correlations. J Clin Microbiol 2000; 38: 1563-1568. 78. Walmsley, S., King, S., McGeer, A., Ye, Y., Richardson, S. Oropharyngeal candidiasis in patients with human immunodeficiency virus: Correlation of clinical outcome with in vitro resistance, serum azole levels, and immunosuppression. Clin Infect Dis 2001; 32: 1554-1561. 79. Powderly, W.G., Kobayashi, G.S., Herzig, G.P., Medoff, G. Amphotericin B-resistant yeast infection in severely immunocompromised patients. Am J Med 1988; 84: 826-832. 80. Clancy, C.J., Nguyen, M.H. Correlation between in vitro susceptibility determined by E-test and response to therapy with amphotericin B: Results from a multicenter prospective study of candidemia. Antimicrob Agents Chemother 1999; 43: 1289-1290. 81. Wenisch, C., Moore, C.B., Krause, R., Presterl, E., Pichna, P., Denning, D.W. Antifungal susceptibility testing of fluconazole by flow cytometry correlates with clinical outcome. J Clin Microbiol 2001; 39: 2458-2462. 82. Powderly, W.G., Keth, E.J., Sokol-Anderson, M. y cols. Amphotericin B-resistant Cryptococcus neoformans in a patient with AIDS. Infect Dis Clin Pract 1992; 1: 314-316.
|