Profilaxis y tratamiento de las infecciones respiratorias causadas por los virus influenza A y B
J. Reina Unidad de Virología, Servicio de Microbiología Clínica, Hospital Universitario Son Dureta, Universidad de las Islas Baleares, Palma de Mallorca.
Los virus influenza A y B son los agentes etiológicos de las epidemias anuales recurrentes de gripe que ocurren en la estación invernal. La gripe es una infección de las vías respiratorias altas y bajas que cursa con un síndrome febril y malestar general. Normalmente se considera una infección leve y autolimitada, pero epidemiológica y socialmente es de gran importancia debido a su impacto sobre la población (1, 2).
El índice de ataque de las infecciones por el virus influenza A es superior al 80% en la población general, aunque las formas graves o con complicaciones sólo afectan al 10% de los infectados. Los grupos de mayor riesgo de padecer las complicaciones de la gripe son las edades extremas de la vida y los pacientes con enfermedades de base debilitantes (1, 2).
La principal estrategia en la prevención de las infecciones por los virus influenza A y B es la vacunación sistemática y repetida de la población susceptible. Como es bien sabido, las variaciones antigénicas menores del virus A obligan a modificar anualmente la composición de las cepas vacunales para poder desarrollar una respuesta inmunitaria adecuada a cada nueva epidemia anual (2, 3).
Ante la elevada posibilidad de aparición de una cepa antigénicamente nueva del virus influenza A (pandemia) (4), las vacunas existentes no podrían utilizarse por no contener la nueva cepa, y además el tiempo mínimo de respuesta en la preparación de una nueva se calcula entre seis y ocho meses (4, 5). Por lo tanto, la OMS recomienda realizar estudios sobre la eficacia de los diferentes antivirales conocidos en la profilaxis de la población general frente a esta posible pandemia (6, 7).
Se han revisado los principales fármacos antivirales con eficacia frente a los virus influenza A y B y su posible utilidad tanto en la prevención como en el tratamiento de las infecciones respiratorias por ellos causadas.
AMANTADINA Y RIMANTADINA
En la actualidad, los dos fármacos antivirales de elección en el tratamiento de las infecciones causadas por los virus influenza A y B son la amantadina y la rimantadina.
La amantadina (clorhidrato de L-adamantanamina) es una amina primaria con un anillo alicíclico en la posición C-10, y la rimantadina (clorhidrato de a-metil-L-adamantina metilamina) es un análogo de ella (4, 7) (Fig. 1).
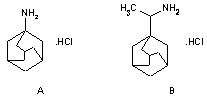
- La eficacia clínica de la
amantadina fue comunicada y aceptada para su uso terapéutico hace ya más de 30 años
(8). A pesar de ser el único fármaco efectivo para las infecciones por el virus
influenza A, tardó más de 20 años en utilizarse de forma habitual. La principal razón
para ello fueron los efectos adversos de este fármaco, que obligaban a utilizarlo sólo
en casos muy concretos y no indiscriminadamente. En la actualidad todavía no se realiza
un uso general de este fármaco para el tratamiento de las infecciones graves causadas por
el virus influenza A, pero se conocen mucho mejor sus beneficios terapéuticos y sus
posibles efectos indeseables.
Actividad antiviral
Ambos fármacos son altamente eficaces in vitro e in vivo frente a los distintos tipos y subtipos del virus influenza A (8-10). Su eficacia se consigue a muy bajas concentraciones (<1 µg/ml), fácilmente alcanzables con las dosis terapéuticas recomendadas para el ser humano. Debe señalarse, sin embargo, que a esta dosis son ineficaces frente al virus influenza B. En la Tabla 1 aparece el espectro de actividad in vitro de la amantadina frente a diferentes virus, el cual sólo se consigue con dosis más elevadas (10-50 µg/ml) no alcanzables por vía oral (10-12). Los diferentes estudios realizados en animales han demostrado la eficacia de la amantadina no sólo cuando se administra por vía oral sino también por vía peritoneal, y sobre todo en forma de aerosol (13).
Tabla 1. Eficacia antiviral de la amantadina sobre diferentes virus.
Bajas concentraciones
µg/ml)
(1Sólo a altas concentraciones
µg/ml)
(>10Influenza A
Influenza B
Influenza C
Parainfluenza 1-3
Virus respiratorio sincitial
Rubéola
Retrovirus murinos y aviares
Virus Semliki Forest
Coriomeningitis linfocítica
Virus TacaribeLa rimantadina también ha mostrado una elevada eficacia frente al virus influenza A a bajas concentraciones (<1 µg/ml), mostrando un espectro antiviral idéntico al de la amantadina. En diferentes estudios comparativos se ha observado que tanto la amantadina como la rimantadina muestran una CI50 entre 1,0 y 0,4 µg/ml para la mayoría de las cepas clínicas (12, 14).
Mecanismo de acción
Ambos fármacos tienen como diana la proteína viral M2, que actúa en el virus como una proteína transmembrana formadora de canales en la envoltura lipídica (15-18). Los canales formados por la proteína M2 permiten la entrada de iones al virus durante el proceso de descapsidación, desestabilizando las uniones proteína-proteína y permitiendo el transporte del DNA viral al interior del núcleo de la célula huésped (16). Además de ello, los canales M2 modulan los flujos iónicos que determinan el pH intracelular de ciertos compartimientos celulares como el aparato de Golgi (16, 19). Los diferentes cambios de pH en estos compartimientos estabilizan la hemaglutinina del virus influenza A durante el transporte intracelular del virus (20, 21). Así pues, tanto la amantadina como la rimantadina interfieren en el correcto funcionamiento de los canales proteicos M2 (15, 18).
Resistencia
El principal mecanismo de resistencia viral a ambos fármacos lo constituyen las mutaciones producidas en el dominio transmebrana de la proteína M2. La secuencia aminoácida, y por lo tanto genética, de esta región transmembrana está altamente conservada en la mayoría de los virus influenza A humanos y animales (19). De este modo se ha visto que las cepas humanas del virus influenza A con resistencia a estos fármacos presentan sustituciones puntuales de aminoácidos en una de las cinco posiciones esenciales (aminoácidos 26, 27, 30, 31 y 34) del dominio transmembrana de la proteína M2 (14, 22).
Los datos disponibles parecen demostrar que las cepas con resistencia a bajas concentraciones de amantadina (<1 µg/ml) presentan este tipo de mutaciones puntuales en el gen codificador de la proteína M2 (23, 24). Sin embargo, en las cepas resistentes a concentraciones elevadas de este fármaco (>50 µg/ml), la resistencia se debe a modificaciones en los valores de pH >5,5 necesarios para los procesos de fusión endosomal que se producen en el citoplasma de la célula huésped, y que además se asocian a mutaciones en el gen que codifica la hemaglutinina viral (25, 26).
Los mecanismos de resistencia frente a la rimantadina han sido poco estudiados, pero parecen ser similares a los descritos. De este modo, la resistencia a uno de ellos determina resistencia cruzada al otro fármaco (27).
Farmacocinética
En la actualidad ambos fármacos sólo están disponibles para administración por vía oral. A pesar de su semejanza estructural, la amantadina y la rimantadina difieren en su farmacocinética. La amantadina es rápida y completamente absorbida tras su administración y alcanza el pico máximo plasmático aproximadamente a las dos horas. Se excreta completamente por vía renal por filtración glomerular y secreción tubular. Su vida media es variable, pero cercana a las 15 horas. El volumen de distribución de la amantadina es amplio y apenas se elimina durante el proceso de hemodiálisis. En los seres humanos la concentración nasal y respiratoria es casi la misma que la plasmática, siendo además excretada por la leche (12, 28).
La rimantadina también muestra una absorción completa, pero mucho más lenta. Así, el pico máximo plasmático se alcanza aproximadamente a las cinco horas de su administración y por lo tanto sus concentraciones son el 50% de las alcanzadas por la amantadina. La excreción de este fármaco también se realiza por vía renal y presenta una vida media de unas 30 horas. Su volumen de distribución es parecido al de la amantadina y parece concentrarse en el moco nasal (12, 29, 30).
Implicaciones clínicas
En los diferentes modelos animales se ha podido observar que la resistencia del virus influenza A a la amantadina y la rimantadina es un fenómeno que emerge rápidamente durante la terapia antiviral, es genéticamente estable, se puede transmitir a los contactos y anula la posibilidad de utilizarlos como profilácticos (31-33). Se ha observado cómo la frecuencia de fracasos profilácticos con amantadina debidos a cepas resistentes, en brotes en comunidades cerradas, pueden ser del 0,5% al 2,4% (34-37). Las cepas resistentes se han mostrado totalmente virulentas, de modo que las mutaciones que confieren este aspecto no afectan a los genes implicados en los procesos patogénicos esenciales, y son capaces de producir enfermedad clínica en el paciente que las adquiere (35, 37). Por lo tanto, resulta obligado realizar un seguimiento epidemiológico de estas cepas, en particular ante la práctica cada vez más frecuente de la profilaxis con amantadina en las grandes epidemias de gripe ocurridas en China (7, 34), país de origen de la mayoría de las cepas epidémicas y pandémicas (6, 7).
Algunos estudios de vigilancia epidemiológica han demostrado la existencia de un 0,8% de cepas naturalmente resistentes a ambos fármacos en poblaciones nunca expuestas a ellos (39, 40). Los estudios clínicos en humanos también han demostrado que la aparición de resistencia es un proceso rápido, de modo que a los tres a cinco días de iniciada la terapia cerca del 30% de los niños y adultos tratados excretaban cepas resistentes (39, 40). A pesar de ello, la excreción de mutantes resistentes no parece asociarse a un empeoramiento de las manifestaciones clínicas del paciente, aunque acostumbran a presentar infecciones más duraderas en comparación con las de los pacientes con cepas salvajes (35-40). La excreción de estas cepas mutantes dura poco tiempo y acostumbra a desaparecer antes de diez días tras el inicio de la terapia antiviral (34).
Aplicaciones clínicas
Una de las principales aplicaciones de estos antivirales es la prevención de la infección que ocurre anualmente en una determinada población. En la literatura existen unos 35 estudios sobre este aspecto que engloban unos 30.000 pacientes, incluyendo niños, adultos y ancianos (40). En la población sana, la administración de amantadina o rimantadina diaria durante cinco a siete semanas (200 mg/día) determinó una protección frente a la infección que oscilaba entre el 39% y el 91%, y frente a la enfermedad del 71% al 100% (41-44).
Existen más de 25 estudios sobre la eficacia terapéutica de ambos antivirales en las infecciones por el virus influenza A. La mayoría de los estudios realizados en personas sanas han mostrado una reducción en la frecuencia de aislamientos de virus y en la concentración de partículas virales en las secreciones respiratorias. Por lo tanto, el beneficio clínico se basa fundamentalmente en su significativo efecto antiviral (45-48). Cuando se inicia el tratamiento en los primeros días de aparición de los síntomas se consigue una recuperación mucho más rápida, calculada en unos dos o tres días si se compara con los grupos placebo (45, 48). No ha podido establecerse de forma definitiva si el tratamiento es efectivo en los procesos gripales graves o en la prevención de las complicaciones (neumonías) que aparecen en los pacientes de alto riesgo (40, 49).
Recomendaciones de uso
La vacunación sigue siendo el principal sistema de profilaxis y control de las infecciones causadas por los virus influenza A y B. Sin embargo, algunas personas y circunstancias pueden beneficiarse del empleo profiláctico o terapéutico de la amantadina y la rimantadina. La amantadina no está aprobada para su empleo en niños menores de un año, embarazadas ni madres lactantes.
Profilaxis
Ambos fármacos antivirales pueden administrarse a lo largo de la estación epidémica a las personas con alto riesgo de padecer infecciones complicadas por los virus gripales, siempre y cuando no hayan sido vacunadas o la vacuna no determine una suficiente protección inmunológica (34, 42-44).
Los grupos de riesgo incluyen niños y adultos con enfermedades crónicas cardiacas o pulmonares, niños con asma, personal sanitario que cuida poblaciones susceptibles, personas sanas de más de 65 años que viven en comunidades cerradas y pacientes con enfermedades sistémicas debilitantes (inmunodepresión, nefropatías, hemoglobinopatías). Los estudios realizados en instituciones cerradas con brotes de infección viral parecen demostrar la necesidad de realizar tan sólo una profilaxis corta, de dos a tres semanas, incluyendo a las personas previamente vacunadas (34, 40).
La profilaxis también debería ofrecerse a todas las personas inmunodeprimidas aunque se hayan vacunado, así como durante las dos primeras semanas tras la vacunación, en las cuales la protección inmunológica es todavía insuficiente (51, 52).
El principal problema de la profilaxis, aparte la inducción de resistencias, es la aparición de efectos adversos. La amantadina presenta una actividad estimuladora del sistema nervioso central, probablemente mediante la liberación de catecolaminas (52). Los síntomas asociados a este fenómeno son nerviosismo, insomnio y dificultad de concentración. También presentan afectos indeseables de tipo gastrointestinal (náuseas, vómitos y dispepsia), que se producen en el 10% de los pacientes (29, 30, 53, 54).
Los efectos colaterales de la amantadina se relacionan con la dosis administrada y con la concentración plasmática del fármaco. Los principales efectos son confusión, alucinaciones y convulsiones (12). Los efectos adversos y colaterales de la rimantadina son similares a los de la amantadina, aunque algo más leves y menos frecuentes (12, 39, 40, 53).
Tratamiento
El tratamiento con amantadina y rimantadina acorta la duración de la fiebre, los síntomas, las alteraciones funcionales respiratorias y la excreción viral en las vías respiratorias (41-44). Si se administran precozmente son capaces de reducir la frecuencia de infecciones secundarias en un 30% de las familias o comunidades cerradas (42, 43). Las indicaciones del tratamiento son mucho más limitadas que las de la profilaxis e incluyen preferentemente pacientes con alto riesgo de infecciones graves o con complicaciones de éstas. Las dosis terapéuticas se exponen en la Tabla 2. En general se recomienda que el tratamiento no dure más de cinco días, ya que el porcentaje de aparición de resistencias se incrementa con el número de días de tratamiento (39, 40).
Tabla 2. Dosis recomendadas de amantadina y rimantadina.
Tipo de paciente Dosis Edad 1-9 años 5 mg/kg/día
No pasar de 150 mg/díaEdad 10-64 años 200 mg/día Edad >65 años 100 mg/día Insuficiencia renal Amantadina
Rimantadina
La dosis inicial igual que una persona sana para el primer día y luego reducir la dosis hasta el valor equivalente de 200 mg ´ (depuración creatinina/100)
100 mg/día si la depuración de creatinina es <10 ml/min
AVIRINA
La ribavirina es un nucleósido sintético (1-b-d-ribofuranosil-1H-1,2,4-triazol-3-carboxamida) (Fig. 2) con un espectro antiviral in vitro y en modelos animales muy amplio, que incluye tanto a los virus influenza A y B como a la mayoría de los paramixovirus (55, 56).
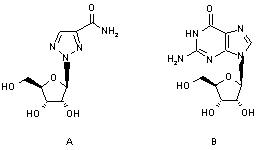
- La ribavirina es un falso
nucleósido semejante a la guanosina y su principal mecanismo de acción es competir con
la guanosina natural (inhibición competitiva). Sin embargo, en el caso del virus
influenza A, además de esta acción parece que la ribavirina determina un descenso de la
concentración intracelular de GTP mediante su inhibición competitiva con la inosina
monofosfato, inhibición de la formación del cap en posición 5’ en el RNA mensajero
e inhibición del complejo virus-RNA polimerasa (57, 58).
Aunque los primeros estudios sugerían cierto efecto terapéutico de la ribavirina frente a las infecciones humanas por el virus influenza A, estudios posteriores han demostrado una eficacia mínima en estos casos (59). La administración oral de ribavirina a dosis de 1000 mg/día no ha demostrado apenas efecto terapéutico cuantificable y, sobre todo, no consigue disminuir la excreción de partículas virales en las secreciones respiratorias (59). La administración de ribavirina en aerosol sí parece mostrar algo más de eficacia terapéutica. Así, se ha comprobado que determina un acortamiento del periodo febril, un descenso del valor máximo de la fiebre y una mejoría general del paciente (60), aunque los estudios clínicos amplios todavía son escasos y no pueden extraerse conclusiones definitivas. Existe un estudio que demuestra que la administración intravenosa de ribavirina puede tener cierta eficacia clínica en el tratamiento de la neumonía grave por el virus influenza A (61); sin embargo, hacen falta ensayos clínicos que confirmen estos resultados.
INHIBIDORES DE LA NEURAMINIDASA
La neuraminidasa del virus influenza A es una proteína con actividad enzimática (sialidasa) que hidroliza los radicales de ácido siálico (ácido N-acetilneuramínico) existentes en diferentes glucoconjugados celulares. Esta actividad enzimática determina la salida del virus de la célula infectada y evita la formación de agregados o acúmulos virales no infectivos (62, 63).
La cristalización de la enzima ha permitido sintetizar análogos del ácido siálico como potentes inhibidores de la actividad neuraminidasa (64-66). Uno de éstos, el zanamivir (GG167,4-guanidino-Neu5Ac2en), ha mostrado una elevada capacidad para inhibir la replicación del virus influenza A tanto in vitro como en modelos animales y en epitelios humanos infectados (65, 66).
Uno de los principales problemas de estos inhibidores es la importante variabilidad de cada cepa, pues el rango de inhibición enzimática oscila entre 0,007 y 5,3 µg/ml para cepas clínicas (66). Aunque se ha demostrado su eficacia contra todos los subtipos conocidos del virus influenza A, la variabilidad en la capacidad inhibitoria, difícil de predecir en una cepa clínica, dificulta su aplicación clínica en estos momentos.
La administración intranasal de zanamivir ha mostrado tener una muy buena actividad antiviral en el modelo murino, cien veces más potente como inhibidor (a la dosis equivalente) que la amantadina y más de mil veces más activo que la ribavirina en la reducción de la mortalidad y la consolidación pulmonar en la neumonía por el virus influenza A (64, 65, 67). La eficacia de este fármaco desaparece cuando se administra por vía oral o sistémica, debido a su incapacidad para penetrar en las células, muy baja biodisponibilidad, falta de distribución desde la sangre a las vías respiratorias y excreción renal muy rápida (65).
Desde el punto de vista profiláctico, la administración intranasal de zanamivir ha mostrado una eficacia protectora del 82% frente a la infección por el virus influenza A y del 95% frente a la enfermedad febril en humanos (68). Todos estos resultados iniciales parecen indicar un buen futuro para este nuevo fármaco antiviral, en particular en su aplicación tópica intranasal o en aerosol.
OTROS ANTIVIRALES
En los últimos años ha ido apareciendo un gran número de sustancias químicas con actividad antiviral que utilizan como diana diferentes estructuras o proteínas de los virus influenza A y B (hemaglutinina, neuraminidasa, proteína M2, proteínas de fusión y adhesión) (69-72). Todas ellas están todavía en fase experimental y quizás tan sólo deba hacerse referencia en este momento a un amplio grupo de compuestos derivados del ácido 2,4-dioxobutanoico, con sustituciones en posición 4, que han mostrado capacidad in vitro para inhibir la actividad endonucleasa y la replicación viral a concentraciones muy bajas (69-72). Uno de estos compuestos ha resultado activo administrado tópicamente en la mucosa nasal de ratones infectados por el virus influenza A (72).
BIBLIOGRAFÍA
- Betts, R.F. Influenza virus. En: Mandell, G.L., Bennett, J.E., Dolin, R. (Eds.). Principles and practice of infectious diseases. Chuchill Livingstone, New York 1995; 1546-1567
- Murphy, B.R., Webster, R.G. Orthomyxoviruses. En: Fields, B.N., Knipe, D.M., Howlet, P.M. (Eds.). Fields Virology, 3rd ed. Lippincott-Raven Publishers, Philadelphia 1996; 1397-1445
- Webster, R.G., Bean, W.J., Gorman, O.T., Chambers, T.M., Kawaoka, Y. Evolution and ecology of influenza A viruses. Microbiol Rev 1992; 58: 152-179
- Monto, A.S., Iacuzio, D.A., LaMontagne, J.R. Pandemic influenza. Confronting a reemergent threat. J Infect Dis 1997; 176 (Suppl.): 1-3
- Hampson, A.W. Surveillance for pandemic influenza. J Infect Dis 1997; 176 (Suppl.): S8-S13.
- Palese, P., Zavala, F., Muster, T., Nussenzweig, R.S., García-Sastre, A. Development of novel influenza virus vaccine and vectors. J Infect Dis 1997; 176 (Suppl.): S45-S49.
- Monto, A.S. Prospects for pandemic influenza control with currently available vaccines and antivirals. J Infect Dis 1997; 176 (S): 32-37.
- Davies, W.L., Grunert, R.R., Haff, R.F. y cols. Antiviral activity of 1-adamantanamine (amantadine). Science 1964; 144: 862-863.
- Hoffman, C.E. Amantadine HCl and related compounds. En: Carter, W.A. (Ed.). Selective inhibitors of viral functions. CRC Press, Cleveland 1973; 199-211.
- Couch, R.B., Six, H.R. The antiviral spectrum and mechanism of action of amantadine and rimantadine. En: Mills, J., Corey, L. (Eds.). New directions in antiviral chemotherapy. Elsevier Science Publishing, Amsterdam 1985; 50-57.11.
- Oxford, J.S., Gallbraith, A. Antiviral activity of amantadine: A review of laboratory and clinical data. Pharmacol Ther 1980; 181-262.
- Hayden, F.G., Minocha, A., Spyken, D.A. Comparative single-dose pharmacokinetics of amantadine hydrochloride and rimantadine hydrochloride in young and elderly adults. Antimicrob Agents Chemother 1985; 28: 216-221.
- Grunert, R.R., McGahern, J.W., Davies, W.L. The in vivo antiviral activity of 1-adamantanamine (amantadine). Prophylactic and therapeutic activity against influenza viruses. Virology 1965; 26: 262-269.
- Belshe, R.B., Burk, B., Newman, F., Cerruti, R.L., Sim, I.S. Resistance of influenza A virus to amantadine and rimantadine: Results of one decada of surveillance. J Infect Dis 1989; 159: 430-475.
- Pinto, L.H., Holsinger, L.J., Lamb, R.A. Influenza virus M2 protein has ion channel activity. Cell 1992; 517-528.
- Lamb, R.A., Holsinger, L.J., Pinto, L.H. The influenza A virus M2 ion channel protein and its role in the influenza virus life cycle. En: Wimmer, E. (Ed.). Receptor-mediated virus entry into cells. Cold Spring Harbor Press, New York 1994; 303-321.
- Tosteson, M.T., Pinto, L.H., Holsinger, L.J., Lamb, R.A. Reconstitution of the influenza virus M2 ion channel in lipid bilayers. J Mem Biol 1994; 142: 117-126.
- Wang, C., Lamb, R.A., Pinto, L.H. Direct measurement of the influenza A virus (M2) protein ion channel activity in mammalian cells. Virology 1994; 205: 133-140.
- Hay, A.J. The action of adamantanamines against influenza A viruses: Inhibition of the M2 ion channel protein. Sem Virol 1992; 3: 21-30.
- . Takeuchi, K., Lamb, R.A. Influenza virus M2 protein ion channel activity stabilizes the native form of fowl plague virus hemagglutinin during intracellular transport. J Virol 1994; 68: 911919.
- Takeuchi, K., Shaughnessy, M.A., Lamb, R.A. Influenza virus M2 protein ion channel activity is not required to maintain the equine-1 hemagglutinin in its native form in infected cells. Virology 1994; 202: 1007-1011.
- Belshe, R.B., Smith, M.H., Hall, C.B., Betts, R., Hay, A.J. Genetic basis of resistance to amantadine emerging during treatment of influenza virus infection. J Virol 1988; 62: 1508-1512.
- Lubeck, M.D., Schulman, J., Palese, P. Susceptibility of influenza A viruses to amantadine is influenced by the gene coding for M protein. J Virol 1978; 12: 710-716.
- Hay, A.J., Walstenhome, A.J., Skehel, J.J., Smith, M.H. The molecular basis of the specific anti-influenza action of amantadine. EMBO J 1985; 4: 3021-3024.
- White, J., Kielian, M., Helenius, A. Membrane fusion proteins of enveloped animal viruses. Q Rev Biophys 1983; 16: 151-195.
- Daniels, R.S., Downie, J.C., Hay, A.J., Knossow, M., Skehel, J.J., Wang, M.L., Wiley, D.C. Fusion mutants of the influenza virus hemagglutinin glycoprotein. Cell 1985; 40: 431-439.
- Wang, C., Takeuchi, K., Pinto, L.H., Lamb, R.A. Ion channel activity of influenza A virus M2 protein: Characterization of the amantadine block. J Virol 1993; 67: 5585-5594.
- Bleidner, W.E., Harmon, J.B., Hewes, W.E. Absorption, distribution and excretion of amantadine hydrochloride. J Pharmacol Exp Ther 1965; 150: 1-7.
- Tominack, R.L., Hayden, F.G. Rimantadine hydrochloride and amantadine hydrochloride use in influenza A virus infections. Infect Dis Clin North Am 1987; 1: 459-478.
- Wills, R.J. The clinical pharmacokinetics of rimantadine. J Respir Dis 1987; 8: S39-S50.
- Beard, C.W., Brugh, M., Webster, R.G. Emergence of amantadine resistant H5N2 avian influenza virus during a simulated layer flock treatment program. Avian Dis 1987; 31: 533-537.
- Bean, W.J., Threlkeld, S.C., Webster, R.G. Biological potential of amantadine resistant influenza A virus in an avian model. J Infect Dis 1989; 159: 1050-1056.
- Sweet, C., Hayden, F.G., Jakerman, K.J., Grambas, S., Hay, A.J. Virulence of rimantadine-resistant human influenza A (H3N2) viruses in ferrets. J Infect Dis 1991; 164: 969-972.
- Hayden, F.G. Antivirals for pandemic influenza. J Infect Dis 1997; 176 (Suppl.): 56-61.
- Mast, E.E., Harmon, M.W., Gravenstein, S. Emergence and possible transmission of amantadine-resistant viruses during nursing home outbreaks of influenza A (H3N2). Am J Epidemiol 1991; 134: 988-997.
- Degelau, J., Somani, S.K., Cooper, S.L., Heggenes, M.H., Smith, P.R. Amantadine-resistant influenza A in nursing facility. Arch Intern Med 1992; 152: 390-392.
- Houch, P., Hemphill, M., LaCroix, S., Hirsh, D., Cox, N. Amantadine-resistant influenza A in nursing homes. Arch Intern Med 1995; 155: 533-537.
- Hayden, F.G., Couch, R.B. Clinical and epidemiological importance of influenza A viruses resistant to amantadine and rimantadine. Rev Med Virol 1992; 2: 89-96.
- Hayden, F.G. Amantadine and rimantadine: Clinical aspects. En: Richman, D.D. (Ed.). Antiviral drug resistance. John Wiley & Sons, Chichester 1996; 59-77.
- Couch, R.B. Respiratory virus infections. En: Galasso, G.J., Whitley, R.J., Merigan, T.C. (Eds.). Antiviral agents and human viral diseases, 4th. Lippincott-Raven Publishers, Philadelphia 1997; 369-413.
- Monto, A.S., Gunn, R.A., Bandyck, M.G. Prevention of russian influenza by amantadine. JAMA 1979; 241: 1003-1007.
- Dolin, R., Reichmann, R.C., Madone, H.P., Little, D.W. A controlled trial of amantadine and rimantadine in the prophylaxis of influenza A infection. N Engl J Med 1982; 307: 580-584.
- Clover, R.D., Crawford, S.A., Abell, T.D. Effectiveness of rimantadine prophylaxis of children within families. Am J Dis Child 1986; 140: 706-709.
- Crawford, S.A., Clover, R.D., Abell, T.D. Rimantadine prophylaxis in children: A follow-up study. Pediatr Infect Dis J 1988; 7: 379-383.
- Wingfield, W.L., Pollack, D., Grunert, R.R. Therapeutic efficacy of amantadine HCl and rimantadine HCI in naturally occurring influenza A2 respiratory illness in man. N Engl J Med 1969; 281: 579-584.
- Rabinovich, S., Baldini, J.T., Bannister, R. Treatment of influenza: The therapeutic efficacy of rimantadine HCl in a naturally occurring influenza A2 outbreak. Am J Med Sci 1969; 257: 328-335.
- Hayden, F.G., Monto, A.S. Oral rimantadine hydrochloride therapy of influenza A virus H3N2 subtype infection in adults. Antimicrob Agents Chemother 1986; 29: 339-341.
- Hall, C.B., Dolin, R., Gala, C.L., Reichmann, R.C., Little, D.W. Children with influenza A infection: Treatment with rimantadine. Pediatrics 1987; 80: 275-282.
- Kimberlin, D.W., Whitley, R.J. Antiviral resistance: Mechanisms, clinical significance and future implications. J Antimicrob Chemother 1996; 37: 403-421.
- Couch, R.B., Kasel, J.A., Glezen, W.P., Hall, C.B. Influenza: Its control in persons and populations. J Infect Dis 1986; 153: 431-440.
- Centers for Disease Control. Prevention and control of influenza: Recommendations of the Advisory Committee on Inmunization Practices. MMWR 1995; 44: 10-18.
- Vernier, V.G., Harmon, J.B. The toxicologic and pharmacologic properties of amantadine hydrochloride. Toxicol Appl Pharmacol 1969; 15: 642-665.
- Hayden, F.G., Gwaltney, J.M., Van de Castle, R.L. Comparative toxicity of amantadine hydrochloride and rimantadine hydrochloride in healthy adults. Antimicrob Agents Chemother 1981; 19: 226-233.
- Atmar, R., Greenberg, S.B. Safety and pharmacokinetics of rimantadine small-particle aerosol. Antimicrob Agents Chemother 1990; 34: 2228-2233.
- Sidwell, R.W. Ribavirin: In vitro antiviral activity. En: Smith, R.A., Kirkpatrick, W. (Eds.). Ribavirin: A broad spectrum antiviral agent. Academic Press, New York 1980; 23-42.
- Allen, L.B. Review of in vivo efficacy of ribavirin. En: Smith, R.A., Kirkpatrick, W. (Eds.). Ribavirin: A broad spectrum antiviral agent. Academic Press, New York 1980; 43-58.
- Gilbert, B.E., Knight, V. Biochemistry and clinical applications of ribavirin. Antimicrob Agents Chemother 1986; 30: 201-205.
- Wray, S.K., Gilbert, B.E., Noall, M.W. Mode of action of ribavirin: Effect of nucleotide pool alterations on influenza virus ribonucleoprotein synthesis. Antiviral Res 1985; 5: 29-37.
- Smith, C.B., Charette, R.P., Fox, J.P., Douglas, R.G. Lack of effect of oral ribavirin in naturally occurring influenza A virus (H1N1) infection. J Infect Dis 1980; 141: 548-554.
- McClung, H.W., Knight, V., Gilbert, B.E. Ribavirin aerosol treatment of influenza B virus infection. JAMA 1983; 249: 2671-2674.
- Hayden, F.G., Sable, C.A., Connor, J.D., Lane, J. Intravenous ribavirin by constant infusion for serious influenza and parainfluenza virus infection. Antiviral Ther 1996; 1: 51-56.
- Palese, P., Compans, R.W. Inhibition of influenza virus replication in tissue culture by 2-deoxy-2,3-dehydro-N-trifluoroacetyl-neuraminic acid (FANA): Mechanisms of action. J Gen Virol 1976; 33: 159-163.
- Colman, P.M., Verghese, J.N., Laver, W.G. Structure of the catalytic and antigenic sites in influenza virus neuraminidase. Nature 1983; 303: 41-44.
- Von Itzstein, M., Wu, W.Y. Rational design of potent sialidase-based inhibitors of influenza virus replication. Nature 1993; 363: 418-423.
- Ryan, D.M., Ticehurst, J., Dempsey, M.H., Coates, J.A., Bethell, R.C. Inhibition of influenza virus replication in mice by GG167 is consistent with extracellular activity of viral neuraminidase (sialidase). Antimicrob Agents Chemother 1994; 38: 2270-2275.
- Hayden, F.G., Rollins, B.S., Madren, L.K. Anti-influenza virus activity of the neuraminidase inhibitor 4-guanidino-Neu5Ac2en in cell culture and in human respiratory epithelium. Antiviral Res 1994; 25: 123-131.
- Ryan, D.M., Ticehurst, J., Dempsey, M.H. GG167 is a potent inhibitor of influenza virus in ferrets. Antimicrob Agents Chemother 1995; 39: 2583-2584.
- Hayden, F.G., Treanor, J.J., Betts, R.F., Lobo, M., Esinhart, J.D., Hussey, E.K. Safety and efficacy of the neuraminidase inhibitor GG167 in experimental human influenza. JAMA 1996; 275: 295-299.
- Leiter, J.M., Agrawal, S., Palese, P., Zamenick, P.C. Inhibition of influenza virus replication by phosphorothioate oligo-deoxynucleotides. Proc Natl Acad Sci USA 1990; 87: 3430-3434.
- Nagai, T., Moriguchi, R., Suzuki, Y., Tominori, T., Yamada, H. Mode of action of the anti-influenza virus activity of plant flavonoid 5,7,4’trihydroxy-8-methoxyflavone, from the roots of Scutellaria baicalensis. Antiviral Res 1995; 26: 11-25.
- Yamada, Y., Shimokata, K., Yamada, Y., Yamamoto, N., Goshina, F., Nishiyama, Y. Inhibition of influenza A virus replication by a kanamycin derivative. Antiviral Res 1991; 15: 171-182.
- Ovcharenko, A.V., Zhirnov, O.P. Aprotinin aerosol treatment of influenza and paramyxovirus bronchopneumonia of mice.Antiviral Res 1994; 23: 107-118.