ROXITROMICINA Y ASMA: EXPERIENCIA CLÍNICA
La administración de macrólidos entre y durante las crisis asmáticas
ya ha sido probada con cierto éxito en tratamientos con una duración de tres a nueve
semanas (47). En concreto, Black (48), administrando roxitromicina entre diez días y un
mes a dosis de 150 mg/día por vía oral, y tras varios meses de estudio, concluye que los
asmáticos tratados presentaban un menor número de crisis, un mayor distanciamiento entre
éstas, una clara mejoría funcional y, en consecuencia, un menor uso de corticoides.
Koh y cols. (49) han estudiado recientemente la respuesta al
tratamiento con roxitromicina de un grupo de 25 niños con bronquiectasias e
hiperreactividad bronquial determinada por la prueba de la meticolina. En total 13 de
ellos recibieron 150 mg/día por vía oral durante dos semanas y el resto (12 niños)
placebo. A diferencia de estos últimos, los niños del grupo tratado con roxitromicina
presentaron una menor purulencia en sus secreciones y una notable reducción del número
de neutrófilos en el esputo, todo ello acompañado de una significativa mejoría
clínica.
Kadota y cols. (50) realizaron un estudio clínico similar en el cual
incluyeron pacientes con enfermedad obstructiva en fase aguda y valoraron, antes y
después del tratamiento con roxitromicina, 150 mg/día durante tres meses, neutrófilos,
IL-1b e IL-8 en sangre periférica o fluidos broncoalveolares, y diversos parámetros
funcionales [capacidad vital, volumen expiratorio máximo por segundo (VEMS), presión
arterial de oxígeno (PaO2)] (Tabla 1). Valorando sus resultados podemos comprobar que
tras el tratamiento con roxitromicina mejoraron notablemente los parámetros inflamatorios
e infecciosos (IL-1b, IL-8, neutrófilos), y especialmente la función pulmonar.
Tabla 1. Análisis de fluido broncoalveolar, sangre y función pulmonar
en pacientes con enfermedad obstructiva en fase aguda, antes y después del tratamiento
con roxitromicina (150 mg/día durante tres meses) (53).
| Parámetro |
Antes |
Después |
Control |
p |
| Neutrófilos (%) IL-1B (pg/ml)
IL-8 (pg/ml)
Capacidad vital (%)
VEMS (l)
PaO2 (torr) |
62,6 ± 21,8
40,1 ± 5,6
418,8 ± 102
86,9 ± 20,2
1,8 ± 0,9
74,2 ± 10,4 |
21,7 ± 22,6
21,8 ± 2,1
91,5 ± 28,5
96,0 ± 21,9
2,1 ± 1,1
84,3 ± 10,9 |
0,8 ± 0,7
22,6 ± 6,5
5,5 ± 1,8
–
–
– |
0.001
0.05
0.01
0.001
0.01
0.01 |
Corroborando estos datos, diversas investigaciones recientes, como la
de Biscione y cols. (51), han comprobado in vitro que la producción de IL-1 y de IL-6 en
las células del epitelio bronquial humano se sitúa en cifras muy elevadas cuando se
encuentran infectadas por bacterias intracelulares, pero si proporcionamos roxitromicina a
estas células, la producción de dichos mediadores de la fisiopatología asmática se
reduce de forma significativa, lo que demuestra la capacidad antiinflamatoria de la
roxitromicina y sugiere su eficacia en el paciente asmático.
ASMA Y ROXITROMICINA: EXPERIENCIA PROPIA
Basándonos en las investigaciones citadas, durante los últimos meses
hemos realizado un estudio clínico a doble ciego y aleatorizado, con dos grupos de 20
pacientes con asma leve o moderada. Uno de los grupos, además de su tratamiento habitual
recibió roxitromicina, 300 mg/día por vía oral durante 21 días, y el otro placebo
durante el mismo tiempo. Una vez finalizado el tratamiento comparamos la evolucion
clínica de cada grupo antes y después del periodo de estudio, para concretar el número
de crisis o episodios asmáticos durante tres meses. Igualmente valoramos el VEMS antes
del tratamiento y tres meses más tarde.
En la Fig. 3 presentamos los resultados obtenidos en lo que se refiere
al número de crisis. En el grupo no tratado (grupo 1), el número de crisis antes del
estudio fue de 1,35 ± 0,43 episodios por persona en tres meses, y después del estudio
1,11 ± 0,37 episodios por persona en tres meses (p >0.05). En los asmáticos tratados
(grupo 2) la media antes del estudio fue de 1,42 ± 0,46 episodios por persona en tres
meses (p >0.05 respecto al grupo no tratado), y después del tratamiento (tras los tres
meses de seguimiento) la media de episodios fue significativamente inferior, situándose
en 0,58 ± 0,19 episodios por persona en tres meses (p <0.05 respecto al grupo no
tratado).
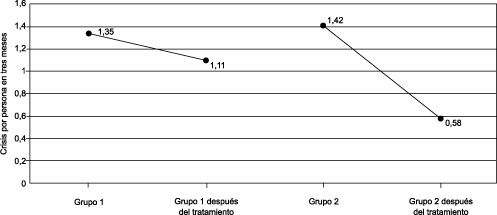
Figura 3. Crisis antes y después del tratamiento (ver
explicación en el texto).
En el caso del VEMS (Fig. 4), aunque no observamos diferencias
significativas entre ambos grupos antes del tratamiento (2,24 ± 0,28 l/segundo en los no
tratados frente a 2,28 ± 0,33 l/segundo en los tratados), sí se aprecia cierta mejoría
en los que recibieron roxitromicina después del tratamiento (2,64 ± 0,37 frente a 2,26
± 0,29 l/segundo, respectivamente; p <0.05).
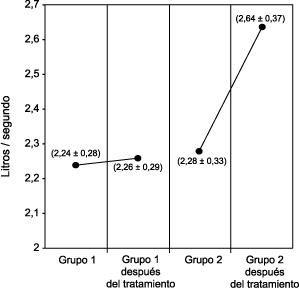
Figura 4. VEMS antes y después del tratamiento con
roxitromicina.
Estos resultados sugieren, en la línea de los estudios de Koh, Kadota
y Black (48-50), que la administración de roxitromicina puede ser útil en la
disminución del número de crisis asmáticas, mejoría de los parámetros funcionales,
mayor espaciamiento de las crisis y, en definitiva, para mejorar los síntomas y la
calidad de vida del paciente asmático.
Otros estudios profundizarán en estos aspectos, como el que
recientemente hemos iniciado con 400 pacientes asmáticos valorando parámetros
serológicos, funcionales y clínicos.
BIBLIOGRAFÍA
- Weiss K.B., Wagener, D.K. Changing patterns of asthma mortality: Identifying target at
high risk. JAMA 1990; 264: 683-685.
- Rao, M., Kravath, R., Abadco, D., Arden, J., Steiner, P. Childhood asthma mortality: The
Brooklyn experience and a brief review. J Assoc Acad Minor Phys 1991; 2: 127-130.
- Libro Blanco de Alergología. Sociedad Española de Alergia e Inmunología Clínica,
Madrid 1998.
- Sterk, P.J. Virus-induced airways hyperresponsiveness in man. Eur Respir J 1993; 6:
894-902.
- Allegra, I., Blasi, F., Centanni, S. y cols. Acute exarcebations of asthma in adlits:
Role of Chlamydia pneumoniae infection. Eur Respir J 1994; 7: 2165-2168.
- Blasi, F. Clinical features of Chlamydia pneumoniae acute respiratory infection. Clin
Microb Inf 1996; 1 (Suppl. 1): 161-168.
- Hahn, D.L., Dodge, R.W., Golubjatnikov, R. Association of Chlamydia pneumoniae (strain
Twar) infection with wheezing, asthmatic bronchitis and adlit-onset asthma. JAMA 1991;
266: 225-230.
- Huhti, E., Mokka, T., Nikoskelainen, J., Halonen, P. Association of viral and mycoplasma
infections with exacerbations of asthma. Ann Allergy 1974; 33: 145-149.
- Bone, R.C. Chlamydia pneumoniae and asthma: A potentially important relationship. JAMA
1991; 20: 266-265.
- Falck, G., Heyman, L., Gnarpe, J., Gnarpe, H. Chlamydia pneumoniae (Twar): A common
agent in acute bronchitis. Scand J Infect Dis 1994; 26 (2): 179-187.
- García, J. Chlamydia pneumoniae: su asociacion con el asma y la enfermedad
cardiovascular. Intervenciones terapéuticas. Rev Esp Quimioterap 1998; 11 (1): 23-28.
- Hahn, D.L. Evidence for Chlamydia pneumoniae infection in asthma. En: Allegra, L.,
Blasi, F. (Eds.). Chlamydia pneumoniae infection. Springer-Verlag, Milan, Italy 1995;
65-75.
- Kadota, J. Non-antibiotic effect of antibiotics. Clin Microb Infect 1996; 1 (Suppl. 2):
20-22.
- Konno, S., Asano, K., Kurokawa, M., Ikeda, K., Okamoto, K., Adachi, M. Antiasthmatic
activity of a macrolide antibiotic: Analysis of possible mechanims in vitro and in vivo.
Int Arch Allergy Appl Immunol 1994; 105: 308-316.
- Grayston, J.T., Aldous, M., Easton, A. y cols. Evidence that Chlamydia pneumoniae causes
pneumoniae and bronchitis. J Infect Dis 1993; 168: 1231-1235.
- Emre, U., Roblin, P.M., Gellin, M. y cols. The association of Chlamydia pneumoniae
infection and reactive airways disease in children. Arch Pediatr Adolesc Med 1994; 148:
727-732.
- Chirgwin, K., Roblin, P.M., Gelling, M., Hammerschlag, M.R., Schachter, J. Infection
with Chlamydia pneumoniae in Brooklyn. J Infect Dis 1991; 163: 757-761.
- Weiss, S.G., Newcomb, R.W., Beem, M.O. Pulmonary assessment of children after chlamydial
pneumoniae of infancy. J Pediat 1986; 108: 659-664.
- Hammerschlag, M.R., Roblin, P.M., Cassell, G. y cols. High prevalence of infection due
to Chlamydia pneumoniae in children with community-acquired pneumoniae. Pediatr Res 1993;
33: 89.
- Jones, R. Puntos esenciales de la conferencia ICMAS II. Venecia, Italia 1994; 2.
- Bergogne-Berezin, E. Nouvelles aproches pharmacologiques des macrolides: Exemple de la
roxithromycine. Press Med 1996; 39: 1982-1988.
- Black, P.N. The use of macrolides in the treatment of asthma. Eur Respir Rev 1996; 38:
240-243.
- Konno, S., Adachi, M., Asano, K., Okamoto, K., Takahashi, T. Antiallergic activity of
roxithromycin inhibition of interleukin-5 production from mouse T-lymphocytes. Life Sci
1993; 52: 25-30.
- Labro, M.T., El Benna, J., Babin-Chevaye, G. Comparison of the in vitro effect of
several macrolides on the oxidative burst of human neutrophils. J Antimicrob Chemother
1989; 24: 561-572.
- Anderson, R. Erythromycin and roxithromycin potentiate human neutrophil locomotion in
vitro by inhibition of leukoattractant-activated superoxide generation and autoxidation. J
Infect Dis 1989; 159: 966-973.
- Young, R.A. Roxitromycin. A review of its antibacterial activity. Pharmacokinetic
properties and clinical efficacy. Drug Evaluation 1989; 37: 8-41.
- Nilsen, O.G. Comparative pharmacokinetics of macrolides. J Antimicrob Chemother 1987; 20
(Suppl, B): 81-88.
- Bergogne-Berezin, E. Tissue distribution of macrolide antibiotics. En: Bryskier, A.J.,
Butzler, J.P., Neu, H.C., Tulkens, P.M. (Eds.). Macrolides. Chemistry, pharmacology and
clinical uses. Arnette Blackwell, Paris 1993; 451-484.
- Campora, E., Camaioni, A., Leonardi, M., Fardella, P., Fiaoni, M. Comparative efficacy
and safety of roxithromycin and clarithromycin in upper respiratory tract infections.
Diagn Microbiol Infect 1992; 15: 119S-122s.
- Bisetti, A. Activity and tolerance of roxithromycin against clarithromycin in the
treatment of lower respiratory tract infections. Roxithromycin Posters ICMAS, 94. Venice,
Italy 1994.
- Tatsis, G., Tsoukalas, G., Boulbasakos, G. y cols. Comparative study of roxithromycin
300 mg once daily vs. clarithromycin 500 mg bid in patients with LRTI. 3rd ICMAS, Lisboa
1996.
- Nilsen, O.G. New macrolides, comparative pharmacokinetic data. VIII Mediterranean
Congress of Chemotherapy, Atenas 1992.
- Saint-Salvi, B., Tremblay, D., Surjus, D., Lefebvre, M.A. A study of the interaction of
roxithromycin with theofyline and carbamazepine. J Antimicrob Chemother 1987; 20 (Suppl.
B): 121-129.
- Boeckh, M., Daeschlein, S., Lode, H., Koeppe, P., Höffken, G. Pharmacokinetics and
interference (by and H2 antagonist and antiacid preparation) in the gastrointestinal
absorption of roxithromycin. 15th Int Cong Chemother, Istambul 1987.
- Ubago, A. Información Terapéutica del Sistema Nacional de Salud 1994; 18 (11):
231-242.
- McLean, A., Sutton, J.A., Salmon, J., Chatelet, D. Roxithromycin: Pharmacokinetic and
metabolism study in man. Br J Clin Pract 1988; 42 (Suppl. 55): 52-53.
- Nilsen, O.G. Roxithromycin. A new molecule, a new pharmacokinetic profile. Drug Invest
1991; 3 (Suppl. 3): 28-32.
- Lode, H., Boeckh, M., Schaberg, T. Human pharmacokinetics of macrolide antibiotics. En:
Bryskier, A.J., Butzler, J.P., Neu, H.C., Tulkens, P.M. (Eds.). Macrolides. Chemistry,
pharmacology and clinical uses. Arnette Blackwell, Paris 1993; 409-420.
- Rubinstein, E. Macrolides: The first choice therapy for adult LRTIS? ICC, Montreal 1995.
- Rimoldi, R., Mangiarotti, P., De Rose, V., Nonis, A., Bertoletti, R., Gialdroni, G.
Penetration of roxithromycin into bronchial secretions. Brit J Clin Pract 1996; (Suppl
55): 74-77.
- Periti, P., Mazzei, T., Mini, E., Novelli, A. Clinical pharmacokinetics properties of
the macrolide antibiotics. Clin Pharmacokin 1989; 16: 193-214.
- Bouvier d´Yvoire, M.J., Tulkens, P.M. Computerized prediction of macrolide antibiotic
concentrations in human circulating polymorphonuclear leucocytes. III ICMAS, Lisboa 1996.
- Nilsen, O.G. Pharmacokinetics of macrolides. Comparison of plasma, tissue and free
concentrations with special reference to roxithromycin. Infection 1995; 23 (Suppl. 1):
5-9.
- Nilsen, O.G., Aamo, T., Zahlsen, K., Svarsa, P. Macrolide pharmacokinetics and dose
scheduling of roxithromycin. Diagn Microbiol Infect Dis 1992; 15: 71-76.
- Bedos, J.P. Evaluation des antibiotiques a diffusion intracellulaire. En: Chastang, C.,
Pons, G., Réginier, B. (Eds.). Methodes nouvelles en pharmacologie clinique pediatrique:
Relation dose-effect des antibiotiques, règles d´arrét d´un essai clinique.
Springer-Verlag, Paris 1992; 39-48.
- Rodríguez, J.M., Rodríguez, J.L., De Lucas, P. Asma bronquial y Chlamydia pneumoniae.
Rev Esp Quimioterap 1998; 11 (Supl. 1): 23-29.
- Hahn, D.L. Treatment of Chlamydia pneumoniae infection in adult asthma: A before-after
trial. J Fam Pract 1995; 41: 345-351.
- Black, P.N. The use of macrolides in the treatment of asthma. Eur Respir Rev 1996; 38:
240-243.
- Koh, Y.Y., Lee, M.H., Sun, Y.H., Sung, K.W., Chae, J.H. Effect of roxithromycin on
airways responsiveness in children with bronchiectasis: A double-blind, placebo-controlled
study. Eur Resp J 1997; 10: 4-9.
- Kadota, J. Non-antibiotic effects antibiotics. Clin Microb Infect 1996; 1 (Suppl. 2):
20-22.
- Biscione, G., Hussain, I.R., Papi, A., Johnston, S.L. Pathophysiology of Chlamydia
pneumoniae infections. 4th ICMASC, Barcelona 1998; 4 (20): 44.