Estado actual de la sensibilidad de
Stenotrophomonas maltophilia
D. Sevillano1, S. Valdezate2
y M.L. Gómez-Lus1
1Departamento de Microbiología I, Facultad de Medicina,
Universidad Complutense de Madrid;
2Centro Nacional de Microbiología, Instituto de
Salud Carlos III, Madrid
RESUMEN
Stenotrophomonas maltophilia ha
de considerarse como un patógeno de creciente importancia,
especialmente en pacientes con factores de riesgo asociados, como
inmunodepresión, enfermedades subyacentes, neoplasias o fibrosis
quística. A lo largo de los últimos años hemos
observado cómo parte de las incógnitas que giraban en
torno a la resistencia que ofrecía a los diferentes antimicrobianos
se han ido disipando gracias a la caracterización de un importante
número de mecanismos de resistencia. Quizá uno de los
mayores problemas que el futuro nos plantea es la urgente necesidad
de encontrar nuevas estrategias de tratamiento, que en todo caso habrán
de ir bien guiadas mediante una correcta estandarización de
las pruebas que se emplean para su valoración. Con este objetivo
repasamos la actualidad de este microorganismo y los recursos con
que podemos contar a muy corto plazo.
Palabras clave: Resistencia
- Stenotrophomonas maltophilia
An update of the susceptibility
of
Stenotrophomonas maltophilia
SUMMARY
Stenotrophomonas maltophilia should
be considered an important pathogen, especially in patients with associated
risk factors, such as immunosuppression, neoplasia and cystic fibrosis.
During the last few years, improvements in characterization of resistance
mechanisms have been made, although the major challenge for the future
is the urgent need to identify new and better alternatives to existing
treatments. Proper standardization of studies used to assess these
new alternatives is required. With this in mind, we have reviewed
the latest information on this organism and the resources available
in the short term.
Key words: Antimicrobial resistance
- Stenotrophomonas maltophilia
Stenotrophomonas maltophilia, previamente
Pseudomonas maltophilia y Xanthomonas maltophilia, es
un bacilo gramnegativo no fermentador ubicuo, pues se encuentra en
el suelo, el agua, los vegetales y los animales, y cuya incidencia
de aparición nosocomial se está viendo incrementada.
En el medio hospitalario se aísla en el agua procedente de
respiraderos, grifos y sumideros, en desinfectantes, jabones, descontaminantes
preoperatorios, tubos con EDTA, reservorios de humidificadores de
oxigenoterapia, catéteres de succión traqueal y bombas
auxiliares cardiopulmonares, y en ocasiones en las manos del personal
sanitario. La vía de entrada de S. maltophilia frecuentemente
se desconoce; se cree que la hospitalización prolongada y la
antibioticoterapia de amplio espectro podrían seleccionar este
microorganismo en las vías respiratorias o el tracto gastrointestinal
de los pacientes o en fuentes ambientales, lo cual explicaría
su alta diversidad genómica (1).
Cultivado de cualquier localización
en pacientes hospitalizados, se encuentra principalmente como microorganismo
contaminante sin acompañarse de clínica. Puede estar
implicado en numerosos procesos infecciosos, pero los más frecuentes
son los de vías respiratorias. Los pacientes con infección
por este microorganismo presentan factores de riesgo intrínseco,
como la inmunodepresión de diferente naturaleza y enfermedades
previas subyacentes: EPOC, cardiovasculares, hepatobiliar, trasplante,
diálisis, VIH, diabetes mellitus, drogadicción, tabaquismo,
alcoholismo... (2). Un factor especialmente asociado a la adquisición
de S. maltophilia es la presencia de neoplasias, destacando
entre ellas las leucemias agudas y el carcinoma de mama. La adquisición
de este microorganismo se asocia principalmente al ámbito hospitalario,
pero sin embargo existen pocos estudios que demuestren su transmisión
nosocomial. Como factores de riesgo extrínsecos se encuentran
la presencia de catéteres vasculares, ventilación asistida
o traqueotomía, técnicas diagnósticas invasoras,
hospitalización prolongada y estancia en UCI, quimioterapia
citotóxica, corticosteroides y muy especialmente la exposición
previa a antibioticoterapia de amplio espectro (3).
Otro grupo afectado por este microorganismo
son los pacientes con fibrosis quística, una población
sometida a antibioticoterapia de amplio espectro, con varios regímenes
anuales de antibióticos y con hospitalizaciones frecuentes,
y de forma añadida las infecciones pulmonares previas y la
enfermedad crónica respiratoria.
Pseudomonas aeruginosa ha sido históricamente
el patógeno gramnegativo no fermentador mayoritariamente aislado
en las infecciones nosocomiales, aunque los datos confirman el incremento
en la aparición de microorganismos como S. maltophilia
y Acinetobacter baumannii, con cifras de incidencia del 14%
y el 7,6%, respectivamente, del total de aislamientos, y con incrementos
considerables desde principios de la pasada década (4).
La mortalidad asociada a S. maltophilia
oscila entre el 14% y el 69%, aunque es difícil atribuirla
en todos los casos a la infección causada por el patógeno
per se, ya que las enfermedades de base de los pacientes contribuyen
claramente a esta elevada tasa (5, 6).
EPIDEMIOLOGEA DE S. MALTOPHILIA
EN EL PACIENTE CON FIBROSIS QUESTICA
Durante las últimas décadas
se ha producido un incremento cuantitativo y cualitativo de las expectativas
de vida del paciente con fibrosis quística. Este hecho ha sido
posible gracias a un mejor conocimiento de los diversos factores involucrados
en dicha enfermedad. Uno de estos factores fundamentales ha sido la
microbiología de las infecciones pulmonares de estos pacientes,
claramente beneficiada por su avance espectacular en las áreas
de la antibioticoterapia y de las técnicas de biología
molecular en la patogénesis de la fibrosis quística.
Todo esto ha contribuido a estudiar,
de forma más profunda, una serie de microorganismos cuya incidencia
se halla en aumento, y así S. maltophilia aparece como
el cuarto por orden de prevalencia, aislado en las secreciones bronquiales
de los pacientes con fibrosis quística, tras P. aeruginosa,
Staphylococcus aureus y Haemophilus influenzae (1, 7).
En los estudios transversales realizados anualmente por el Registro
de la Fundación de Pacientes con Fibrosis Quística Americana,
durante el periodo 1995-1999 se observa un aumento en la colonización
por este microorganismo, con prevalencias desde el 3,4% en 1995, pasando
por el 3,9%, el 5,1% y el 5,4%, hasta el 6,4% en 1999 (7). La importancia
de su detección en las muestras respiratorias de estos pacientes
(8) va en aumento debido al papel que desempeña en la progresión
de la enfermedad pulmonar (1). No obstante, estos datos de prevalencia
pueden hallarse infravalorados principalmente por dos motivos; uno
de ellos es que son datos que aunque incluyen un gran número
de pacientes (21.588 en el año 1999) son proporcionados por
estudios transversales y no longitudinales, que serían los
adecuados dada la aparición intermitente de este patógeno
en el esputo de tales pacientes. El segundo motivo es que el aislamiento
(con medios selectivos e incubación prolongada) y la identificación
de S. maltophilia no son sencillos, con una variación
de aislamiento entre centros desde un 0% hasta un 28% (7).
En un reciente estudio de seguimiento
realizado en España durante el periodo 1991-1998, la tasa de
incidencia anual varió entre el 2,9% y el 14% tras la tipificación
de los aislamientos por electroforesis en campo pulsátil (PFGE),
y además se evidenció que la infección o colonización
por S. maltophilia se producía atendiendo a tres patrones:
a) en un único episodio, situación que acontece en algo
más de la mitad de los pacientes (56%); b) en episodios repetidos
por clones diferentes (19%); c) en episodios repetidos con persistencia
de un mismo clon (25%) (Fig. 1) (9). La repercusión clínica
de la infección o colonización por este microorganismo,
considerado como colonizador tardío o microbiota preterminal
en el paciente con fibrosis quística, es algo controvertida,
entre otras causas por el bajo número de pacientes que integran
los estudios y los aspectos a tener en cuenta. Sin embargo, parece
claro que en pacientes con cultivo positivo para S. maltophilia
la tasa de mortalidad es mayor y los valores del volumen de flujo
espirado son menores que en aquellos pacientes con cultivo negativo
(10, 11), lo cual contribuiría a un deterioro clínico
más rápido cuando la función pulmonar está
disminuida, agravando la situación clínica del paciente
a corto, medio o largo plazo.
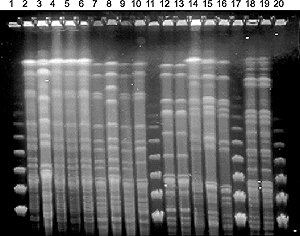
Figura 1. Persistencia clonal de
los pulsotipos obtenidos tras restricción con XbaI en
cepas de S. maltophilia de tres pacientes con fibrosis quística.
Los carriles 2 a 10 corresponden al paciente A: perfil 1a (carriles
2, 4, 5, 6, 7, 9), perfil 1b (carril 8), perfil 1c (carril 10) y perfil
2 (carril 3). Los carriles 12 a 16 corresponden al paciente B: perfil
15 (carriles 12 y 13), perfil 20 (carriles 14, 15 y 16). Los carriles
18 y 19 corresponden al paciente C: perfil 10 (carriles 18 y 19).
Los carriles 1, 11, 17 y 20 corresponden al marcador fago lamda concatémero.
Las terapias antimicrobianas utilizadas
en estos pacientes, capaces de resolver con éxito infecciones
pulmonares por los patógenos clásicos (S. aureus,
H. influenzae y P. aeruginosa), aportarían ventajas
"ecológicas" a este microorganismo multirresistente, convirtiéndolas
en ineficaces. Dado que existe una tendencia generalizada a incrementarse
la incidencia de S. maltophilia en pacientes con fibrosis quística
a partir de los 10 años, alcanzando valores máximos
después de los 18 años, sería interesante mencionar
los agentes más efectivos en el tratamiento de esta infección
que presenta unas características especiales (Tabla 1).
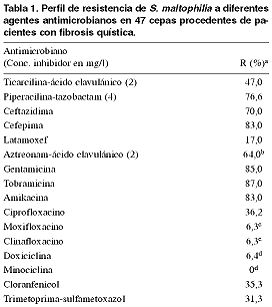
R(%): porcentaje de cepas resistentes;
aaplicando el punto de corte del NCCLS (documento M100-S11);
baplicando el punto de corte del NCCLS para aztreonam;
caplicando el punto de corte de MENSURA para las fluoroquinolonas
(4 mg/l); daplicando el punto de corte del NCCLS para tetraciclina.
TÉCNICAS DE TIPIFICACIIN DE
S. MALTOPHILIA
Los estudios de tipificación
de S. maltophilia son de necesaria aplicación para la
identificación de fuentes ambientales o endógenas y
la transmisión de cepas entre pacientes, permitiendo distinguir
la adquisición de nuevas cepas y la aparición de variantes
más resistentes posteriores al tratamiento antibiótico.
Las técnicas fenotípicas
utilizadas en los estudios epidemiológicos, perfil bioquímico
y sensibilidad a los antimicrobianos han resultado ser poco efectivas
dado el metabolismo relativamente inerte y la homogeneidad en el patrón
de resistencia presentado por S. maltophilia. La detección
mediante aglutinación de los antígenos somáticos
no aporta mayores ventajas dada la alta frecuencia de aparición
de tres serotipos de los 31 que se han definido (12). Otra técnica,
la espectrofotometría de pirólisis de masas, presenta
mayor variabilidad entre las diferentes cepas que los métodos
anteriores, y ha sido utilizada en la investigación de brotes
nosocomiales (13), pero su alto coste y complejidad de realización
la descartan para la investigación epidemiológica.
A fin de obtener una mayor discriminación
recurrimos a las técnicas genotípicas basadas en el
análisis del polimorfismo de los fragmentos de restricción
(RFLP) o en la amplificación de regiones cromosómicas
(PCR). La restricción del DNA con endonucleasas, con mayor
o menor frecuencia de corte, nos va a permitir comparar diferentes
perfiles de bandas o RFLP característicos para cada cepa. La
baja resolución de los numerosos fragmentos generados tras
digestión con enzimas de corte frecuente y separados mediante
electroforesis convencional (REA, análisis con endonucleasas
de restricción) hace que su interpretación sea difícil.
La ribotipificación o hibridación de ácidos nucleicos
con sondas que contienen el operón rrnB de Escherichia
coli, que porta los genes que codifican los RNA 5S, 16S, 23S,
y el RNA-t, ofrece un mayor poder discriminatorio que el REA. Aplicando
la ribotipificación a S. maltophilia se va a generar
un gran número de patrones de bandas, o ribotipos, estables
y reproducibles, que permiten una fácil diferenciación
entre cepas. El grado de discriminación alcanzado con la ribotipificación
dependerá del número de operones ribosomales presentes,
de dos a cinco copias de RNAr por aislamiento de S. maltophilia
y de la endonucleasa de corte frecuente utilizada en los distintos
estudios, BamHI, BclI, Bsu15I, EcoRI,
HindIII (9, 14-16), generándose bandas de hibridación
con un tamaño aproximado de 3 a 20 kb. Cuando se procede a
combinar los ribotipos obtenidos tras restricción con dos enzimas,
la capacidad discriminativa se incrementa. No obstante, esta técnica
ha sido sustituida por otras técnicas genotípicas de
menor complejidad de realización, como la PFGE. Hasta el momento
este método se considera como el que proporciona la diferenciación
definitiva de las cepas de S. maltophilia, siendo utilizado
ampliamente en el estudio de brotes nosocomiales por su gran capacidad
discriminatoria y su buena reproducibilidad. De forma análoga
a la ribotipificación, la utilización de diferentes
endonucleasas y de diferentes condiciones de electroforesis puede
aumentar o disminuir su efectividad en la diferenciación de
pulsotipos. Las enzimas de corte más utilizadas son, fundamentalmente,
DraI (17), SpeI (18) y XbaI (14), siendo XbaI
más efectiva en la diferenciación de cepas con pulsotipos
muy semejantes (9).
Las técnicas genotípicas
de PCR constituyen un método complementario o alternativo a
la PFGE, y aunque presentan menor reproducibilidad y discriminación,
su rapidez y simplicidad de realización y su bajo coste suponen
una gran ventaja. Las diferentes variedades, AP PCR (Arbitrarily-Primed
PCR), RAPD (Randomly-Amplified Polymorphic DNA PCR), ERIC
(Enterobacterial Repetitive Intergenic Consensus PCR), han
sido utilizadas con éxito con objetivos epidemiológicos
y taxonómicos en aislamientos clínicos y ambientales.
El tamaño, el contenido en G+C y el número de cebadores
empleados, así como las condiciones de amplificación,
permiten que el rendimiento de estas técnicas, especialmente
de la RAPD PCR, se aproxime en ocasiones al obtenido con la PFGE (19).
La aplicación de la técnica
de AFLP (Amplified Fragment Lenght Polymorphism) en S. maltophilia
(20) incrementa las posibilidades de discriminación y reproducibilidad
de las técnicas basadas en la PCR, y profundiza en la integración
de las diferentes cepas en líneas clonales distintas. Esta
técnica combina la previa restricción simultánea
del DNA con dos endonucleasas y la ligazón de unos oligonucleótidos
complementarios a la secuencia de corte de la enzima que actúan
como adaptadores, con la realización posterior de una PCR cuyos
cebadores son complementarios a estos adaptadores.
MECANISMOS DE RESISTENCIA
El fenotipo de resistencia múltiple
de S. maltophilia es un proceso multifactorial en el cual participan
una permeabilidad disminuida que impide la entrada del antibiótico,
la falta de un sistema de transporte para ese antibiótico,
en combinación con la producción de enzimas hidrolíticas
o inactivantes, y sistemas de bombeo activo del antibiótico
hacia el exterior de la bacteria. Analicemos de forma detallada estos
mecanismos de resistencia.
Alteraciones en la membrana externa
Durante mucho tiempo se asignó
a la baja permeabilidad de S. maltophilia la causalidad de
su fenotipo multirresistente, pero en la actualidad esta multirresistencia
se justifica, además de por cambios en la composición
de la membrana externa, por una mayor expresión de las proteínas
de membrana externa implicadas en los mecanismos de expulsión
activa. Posiblemente en poco tiempo podamos añadir el conocimiento
de las mutaciones en los genes de regulación de estos sistemas
de flujo. La resistencia a los aminoglicósidos en S. maltophilia
se atribuye principalmente a una baja permeabilidad, aunque las variaciones
en la sensibilidad según la temperatura de incubación
(30 ºC y 37 ºC) son evidentes (21). De este modo, la variabilidad
en la sensibilidad a los distintos aminoglicósidos podría
ser consecuencia de diferencias en la penetración en la célula.
Sistemas de expulsión activa
Recientemente se ha evidenciado la
actuación de sistemas de bombas de expulsión activa
como un factor que contribuiría de forma importante al fenotipo
de resistencia múltiple, sea intrínseca o adquirida,
en S. maltophilia (22, 23). Estos sistemas de flujo se componen
de tres proteínas localizadas en la membrana interna, en el
espacio periplásmico, y en la membrana externa de microorganismos
gramnegativos, formando un canal capaz de eliminar hacia el exterior
de la bacteria un gran número de sustancias mediante un mecanismo
dependiente de protones. Estos sistemas activos destoxificantes, que
se denominan SmeM (Stenotrophomonas multidrug efflux), presentarían
un comportamiento análogo a los descritos en P. aeruginosa;
en este último aumenta su expresión como consecuencia
de mutaciones en los genes reguladores. La resistencia a betalactámicos,
aminoglicósidos, tetraciclinas, macrólidos, cloranfenicol
y quinolonas se incrementa en diferente grado según el tipo
de agente inductor utilizado en la selección in vitro
de mutantes y los sistemas que se encuentren hiperexpresados. Tanto
en mutantes in vitro como en aislamientos clínicos multirresistentes
encontramos aumentada la expresión de una proteína de
membrana externa de 50 kD que reacciona frente a anticuerpos monoclonales
de la OprM, apareciendo también reactividad frente a la proteína
de membrana externa MexB, siendo por tanto el sistema MexAB- OprM
la causa de esta multirresistencia, con su consiguiente relevancia
clínica. En mutantes defectivos para las betalactamasas L1
y L2 continúa existiendo, aunque en menor grado, resistencia
a algunos betalactámicos, lo cual indicaría que el sistema
MexAB-OprM contribuiría en la resistencia a estos agentes.
En los diferentes mutantes in vitro obtenidos con hiperexpresión
de OprM acontecen tres situaciones diferentes en la resistencia a
los aminoglicósidos: el incremento, el mantenimiento o la disminución
de la resistencia con respecto a la cepa madre. La última situación
consistiría en una mayor expresión de un sistema en
detrimento de otro utilizado para los aminoglicósidos. En algunos
mutantes la expresión de OprM no se halla aumentada, mientras
que en otros, además de esta hiperexpresión, se encuentran
otras proteínas que reaccionan con anticuerpos frente a OprJ
y OprN, componentes de los sistemas MexCD-OprJ y MexEF-OprN, ya descritos
en P. aeruginosa (23). Recientemente, y ante la sospecha de
que al igual que en otras especies la resistencia antibiótica
no podía ser atribuida a un único sistema de expulsión,
Alonso y Martínez caracterizaron un nuevo sistema SmeDEF, que
más tarde asociaron a los perfiles de resistencia de diversos
aislamientos clínicos (24, 25).
Producción de betalactamasas
El fenotipo de multirresistencia a
betalactámicos, fundamentalmente de carácter intrínseco,
se debe principalmente a la producción heterogénea de
dos tipos de betalactamasas inducibles, L1 y L2 (26-28). Puesto que
la expresión de betalactamasas es intrínseca e inducible,
se pensó que, análogamente a lo que sucedía con
otras especies bacterianas, la codificación de L1 y L2 era
de tipo cromosómico. Un estudio reciente demuestra que la codificación
de estas enzimas se localiza en un fragmento de tipo plasmídico
de gran tamaño que puede considerarse como parte de un cromosoma
fragmentado (29).
La L1 es una metaloenzima de amplio
espectro, de tercera clase, dependiente de Zn2+, capaz
de hidrolizar a todos los betalactámicos, incluidas penicilina,
cefalosporinas y carbapenemas, excepto monobactamas. Es sensible a
la acción de agentes quelantes como el EDTA, pero no a la de
los inhibidores de betalactamasas. Presenta un contenido en G+C del
68,4% y tiene una masa molecular aproximada de 29 kD, con un pI de
6,5.
La L2 es una cefalosporinasa que contiene
serina en su centro activo, con una resistencia de alto grado a penicilinas
y cefalosporinas, no hidrolizando apenas (0,004% respecto a la cefaloridina)
a las carbapenemas, sensible a la acción de los inhibidores
de betalactamasas, especialmente a la del ácido clavulánico
y el BRL42715 (10 µM), y resistente a la acción del EDTA
(100 µM). Constituida por una proteína con un contenido
en G+C del 71,6% y una masa molecular aproximada de 31,5 kD, presenta
un pI de 8,4. Debido a su gran capacidad para hidrolizar la cefotaxima,
fue clasificada en el grupo funcional 2be.
Existe una gran heterogeneidad genética
en la producción de betalactamasas. Los diversos valores de
pI entre las distintas L1 y L2 de las diferentes cepas se traducen
en variaciones en las secuencias de aminoácidos de estas enzimas,
aunque por el momento existe poca información sobre la asociación
de determinados valores de pI y la presencia de cambios en las secuencias
(26). Esta diversidad en la producción de L1, presente en una
misma especie, es un hecho excepcional, diferenciándose actualmente
cinco isoformas enzimáticas activas codificadas como L1a (30),
1b (31), L1c, L1d y L1e (29), con unos valores de divergencia en la
secuencia de aminoácidos del 21%, 11%, 8% y 19% respecto a
la primera descrita, L1a. Estos alelos de la L1 comparten semejante
actividad hidrolítica sobre el imipenem, a excepción
de la L1e, cuya hidrólisis se halla disminuida de forma importante
(KmL1a = 47 µM, KmL1e = 76 µM) como
consecuencia de sustituciones de aminoácidos en zonas próximas
a la unión con el sustrato que afectan a su anclaje, y en zonas
de unión con el Zn2+ que afectan a la geometría
de las histidinas, y por tanto a la coordinación de los iones
Zn2+ y de las moléculas de agua que participan en
el ataque nucleofílico al anillo del betalactámico.
Dicha variación alélica
también se pone de manifiesto con la betalactamasa L2, que
se diferencia en cuatro alelos, L2a, L2b, L2c y L2d, presentando unos
coeficientes de divergencia de la secuencia proteica del 7%, 5% y
32% respecto a la L2a. Esta variación alélica de los
genes codificadores de betalactamasas puede reflejar una evolución
acelerada, implicándose procesos de transferencia génica
horizontal.
Debido a que en presencia de un betalactámico
inductor se incrementaba la expresión de las dos enzimas, se
pensó que la expresión de ambas se hallaba coordinada
de forma conjunta (32). Datos más recientes indican que estas
enzimas se inducen por distintas vías, posiblemente divergentes,
realizándose el control de la L1 por un regulón de choque
térmico adaptado, mientras que el control de la L2 se realizaría
por el regulador clásico ampR (33).
Recientemente Avison y cols. (34) han
confirmado la presencia de una betalactamasa TEM-2, con un pI de 5,6,
mediada por el gen blaTEM localizado en un transposón,
con elevada homología con Tn1 y Tn2, transferible a
través de un plásmido conjugativo a una cepa de E.
coli, lo que sugiere el posible papel de S. maltophilia
como reservorio para determinantes móviles de resistencia,
intercambiando material genético con otras bacterias.
Enzimas modificantes de aminoglicósidos
De las enzimas modificantes de aminoglicósidos
descritas para otros microorganismos, por el momento sólo se
ha confirmado la presencia de la 6'-N-acetiltransferasa de
tipo I en todas las cepas estudiadas (n = 80), codificada por el gen
cromosómico aac(6')-Iz, que explicaría la resistencia
intrínseca de este organismo a la amikacina, la netilmicina
y la tobramicina, y en menor medida a la gentamicina. La producción
de esta enzima puede sospecharse mediante la difusión en disco,
pues se halla una menor sensibilidad de este microorganismo utilizando
un disco de 2'-N-etilnetilmicina respecto de la que se encuentra
con un disco de 6'-N-etilnetilmicina (35).
Enzimas inactivantes de macrólidos
Un estudio reciente de Alonso y cols.
(36) describe la presencia, en un aislamiento clínico de S.
maltophilia, de un grupo de genes relacionados con la resistencia
a antibióticos y a metales pesados, resultado de la transferencia
a partir de bacterias grampositivas. Uno de estos genes codifica para
una enzima, la macrólido 2'-fosfotransferasa II, que presenta
una elevada homología en proteínas (99,7%) con respecto
a la presente en S. aureus.
Alteraciones en la topoisomerasa II
Los mecanismos implicados en la resistencia
a las quinolonas han sido descritos en una gran variedad de microorganismos
(37), y se deben principalmente a mutaciones específicas localizadas
en las regiones determinantes de la resistencia a quinolonas (QRDR)
de las subunidades constituyentes de las topoisomerasas II (GyrA,
GyrB) y IV (ParC, ParE), además de los mecanismos de flujo
y una permeabilidad disminuida. Cuando se ha procedido a caracterizar
las QRDR de gyrA en aislamientos clínicos de S. maltophilia
sensibles y resistentes a ciprofloxacino, se han encontrado mutaciones
en las posiciones 70, 85, 90, 103, 112, 113, 119 y 124, no encontrando
correlación entre la presencia de una mutación específica
y el incremento de la resistencia a ciprofloxacino, sin hallar las
mutaciones clásicas en las posiciones 83 y 87. Estos resultados
conducirían, de forma inicial, a descartar el papel de gyrA
como diana primaria implicada en la resistencia a las quinolonas (38).
ACTIVIDAD IN VITRO
DE LOS ANTIMICROBIANOS
FRENTE A S. MALTOPHILIA
Perfil actual de sensibilidad
S. maltophilia, que se caracteriza
por presentar una gran diversidad genómica (20, 39), posee,
sin embargo, una gran homogeneidad fenotípica en su perfil
de sensibilidad. Su resistencia intrínseca de alto grado le
confiere un carácter de multirresistencia que hace que no se
vea afectada por la acción de diferentes y numerosos agentes
antimicrobianos. Esta resistencia inherente o natural, en combinación
con las resistencias adquiridas por presión selectiva de los
antimicrobianos, le supone una ventaja ecológica sobre otros
posibles patógenos en el medio hospitalario.
En un estudio reciente de aislamientos
hospitalarios (n = 99) caracterizados mediante PFGE (40), menos del
25% de las cepas estudiadas fueron sensibles a la acción de
la ticarcilina, la piperacilina y el aztreonam, restaurándose
la sensibilidad en las cepas resistentes al combinarse con ácido
clavulánico en un 27,3%, 9,1% y 26,2%, respectivamente (Tabla
2). El efecto del tazobactam sobre las cefalosporinasas, L2, de S.
maltophilia es menor que el del ácido clavulánico
(41). El efecto de este último inhibidor se puede incrementar
utilizando una mayor concentración en su combinación
con el aztreonam, aunque problemas farmacocinéticos obstaculizan
actualmente su aplicación terapéutica (42). Respecto
a la ceftazidima y a la cefepima, aproximadamente el 50% de la población
fue sensible. Entre los betalactámicos que han sido estudiados
hasta el momento, el latamoxef ha demostrado ser el compuesto más
activo, con un porcentaje de resistencia del 2%. Casi todos los aislamientos
resultaron ser resistentes a las carbapenemas, aunque el meropenem
resultó ser del orden de ocho veces más activo que el
imipenem.
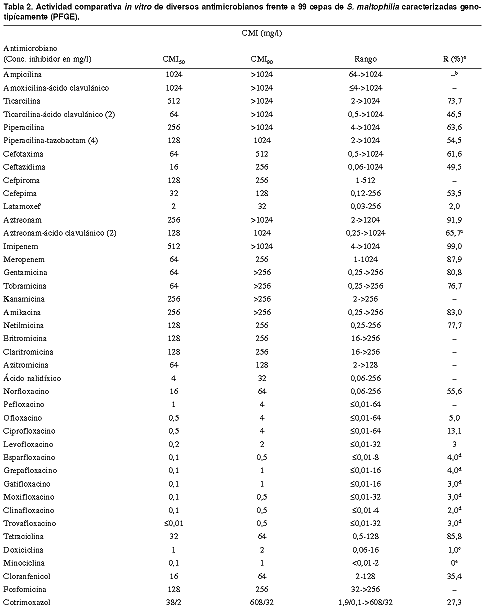
R(%): porcentaje de cepas resistentes;
aaplicando el punto de corte del NCCLS (documento M100-S11);
bpunto de corte del NCCLS no disponible; caplicando
el punto de corte del NCCLS para aztreonam; daplicando
el punto de corte de MENSURA para fluoroquinolonas (4 mg/l); eaplicando
el punto de corte del NCCLS para tetraciclina.
Los aminoglicósidos y macrólidos
muestran una actividad reducida frente a los aislamientos de S.
maltophilia, con un porcentaje de sensibilidad para los aminoglicósidos
inferior al 20%, siendo ligeramente el más activo la tobramicina.
Los valores de CMI90 para los macrólidos son iguales
o superiores a 128 mg/l. Con valores modales de CMI de 1 y de 0,1
mg/l, la doxiciclina y la minociclina muestran una mayor actividad
intrínseca que la tetraciclina (32 mg/l), con unos porcentajes
de sensibilidad iguales o superiores al 99%, al considerar el punto
de corte del NCCLS para la tetraciclina.
Las nuevas quinolonas mejoran su actividad
frente a los aislamientos de S. maltophilia respecto a las
anteriores, inhibiendo a casi todas las cepas estudiadas a las concentraciones
que se alcanzan en el suero y los pulmones (43). Trovafloxacino, clinafloxacino,
gatifloxacino, moxifloxacino y grepafloxacino mostraron una actividad
similar a la de esparfloxacino, inhibiendo el 90% de la población
con valores de CMI de 0,5-1 mg/l; ciprofloxacino mostró una
CMI de 4 mg/l (Fig. 2).
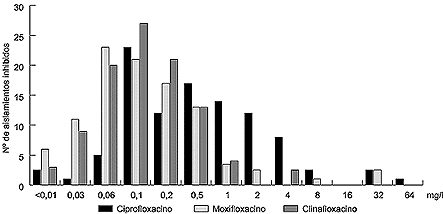
Figura 2. Distribución poblacional
de aislamientos clínicos de S. maltophilia (n = 99)
caracterizados genotipícamente que resultaron inhibidos por
ciprofloxacino, clinafloxacino y moxifloxacino.
El alto valor modal de CMI que muestra
la fosfomicina (128-256 mg/l) la excluye para el tratamiento, mientras
que el cloranfenicol presenta actividad sobre el 64,6% de las cepas
estudiadas. Respecto a la sensibilidad de S. maltophilia al
cotrimoxazol, existe cierta disparidad de resultados entre los diferentes
estudios, posiblemente consecuencia de los distintos métodos,
condiciones y puntos de corte utilizados, que más adelante
comentaremos. Considerando el actual punto de corte del NCCLS (76:4
mg/l), el 27,38% de las cepas son resistentes al cotrimoxazol; si
se observa el comportamiento bimodal de la población 38:2/76:4,
y se aumenta el punto de corte a 152:8 mg/l, el porcentaje de resistencia
disminuye al 11%.
El patrón de sensibilidad de
S. maltophilia a diferentes antimicrobianos ha sido ampliamente
publicado por algunos autores en los últimos años, aportando
resultados en ocasiones poco concordantes. Esto implica no poder extraer
unas conclusiones definitivas sobre la utilidad de unos u otros resultados,
principalmente por las diferencias en los métodos y las condiciones
de incubación utilizados, problema muy frecuente con este microorganismo.
Independientemente de estos aspectos, la caracterización de
los aislamientos previa determinación de la sensibilidad aporta
resultados más precisos acerca de cuál es el estado
actual de la sensibilidad de un patógeno en concreto (43, 44).
Bases de la variabilidad en los resultados
de sensibilidad
La composición del medio de
cultivo es un factor determinante para la realización de las
pruebas de sensibilidad in vitro con S. maltophilia.
Bonfiglio y cols. (45) señalan al medio Isosensitest
como el más adecuado, al aportar menores variaciones en los
resultados. La utilización de agar Mueller-Hinton produjo una
disminución de la sensibilidad a diferentes agentes, especialmente
betalactámicos, que era incluso más acusada cuando progresivamente
se disminuían los nutrientes del citado medio. Del mismo modo,
la concentración de Zn2+ tiene un efecto específico
en la sensibilidad al imipenem, pero no al meropenem, que disminuye
con pequeños incrementos en la concentración de iones.
Al parecer este efecto viene dado porque la betalactamasa L1 necesita
de su estructura multimérica para hidrolizar al imipenem, mientras
que bastaría con la monomérica (que requiere menos zinc)
para hidrolizar al meropenem, ya que si la resistencia principal a
las carbapenemas es mediada por la hidrólisis de la betalactamasa
L1 se deberían de afectar por igual ambos agentes (46, 47).
La dependencia de la metodología
en la determinación de la sensibilidad de S. maltophilia
ha sido ampliamente descrita por varios autores a lo largo de la última
década, ofreciendo resultados poco concordantes entre los métodos
y las recomendaciones del NCCLS para la realización de pruebas
de sensibilidad in vitro (48).
Pankuch y cols. (49) encontraron importantes
diferencias en los resultados de sensibilidad obtenidos mediante distintos
métodos, entre los que se incluía la dilución
en agar, la microdilución en caldo, el E-test®
y la difusión en disco. Demostraron que la dilución
en agar es el método que mejor se correlaciona con los resultados
obtenidos en las curvas de muerte bacteriana para ticarcilina-ácido
clavulánico, piperacilina-tazobactam y ciprofloxacino, y que
por tanto es el más apropiado para la determinación
de la CMI en esta especie, indicando que la difusión en disco,
el E-test® y la microdilución necesitan
ser modificados para correlacionarse mejor con los anteriores métodos
(49). Otros autores (50), sin embargo, encuentran una buena correlación
(94%) entre la dilución en agar y el E-test®,
destacando que para betalactámicos, fluoroquinolonas, cotrimoxazol
y tobramicina el E-test® resulta ser un método
fiable dados los escasos errores graves que ofrece en su comparación.
Traub y cols. (51), ante las discrepancias
suscitadas entre los métodos de difusión y dilución
en agar, propusieron esclarecer esta situación con la inclusión
de nuevos criterios para la interpretación de los resultados
obtenidos por la difusión en disco para aminoglicósidos,
cefalosporinas, cloranfenicol, piperacilina-tazobactam y ticarcilina-ácido
clavulánico, aumentando el diámetro del halo de inhibición
de las cepas integradas en la categoría de sensibilidad intermedia
a los citados antimicrobianos (51).
Carrol y cols. (52) encontraron una
fuerte relación entre los resultados de la difusión
en disco y los del E-test®, e importantes inconsistencias
con los métodos que empleaban caldo, microdilución y
sistemas comerciales de microdilución para todos los agentes
ensayados excepto para el cotrimoxazol, que aparecía como el
agente más estable independientemente del método probado.
Las mayores discrepancias las obtuvieron cuando incrementaron el tiempo
de incubación hasta 48 horas, de igual forma que Pankuch y
cols. (49), que previamente habían establecido que la metodología
que también ofrecía menores variaciones entre los distintos
tiempos de lectura aplicados era la dilución en agar.
En función de sus propios hallazgos
(52) y en relación con anteriores trabajos de su grupo con
modelos de simulación farmacodinámica (53), en los cuales
los recrecimientos bacterianos eran evidentes, Carrol y cols. recomiendan
que con antimicrobianos como doxiciclina, minociclina o cotrimoxazol,
que muestran gran actividad frente al patógeno independientemente
del método y del tiempo de lectura empleados, es preferible
la interpretación de los resultados transcurridas 16-18 horas,
mientras que para agentes bactericidas es aconsejable la incubación
de las pruebas hasta 48 horas. Con este objeto intentaron reconducir
las pruebas de sensibilidad in vitro para la posterior predicción
de los acontecimientos clínicos sin desencadenamiento de fallos
terapéuticos. La independencia de la metodología con
cotrimoxazol, que habían establecido anteriormente diversos
autores (50-52), fue puesta de manifiesto nuevamente por Wiles y cols.
(54) con diversos métodos, entre los que existió una
buena correlación. Las mayores discrepancias ocurrían
con las cepas cuya sensibilidad se encuentra cercana al punto de corte
establecido, recomendando para estas cepas su confirmación
mediante otros métodos. Del mismo modo, otros autores no encontraron
variaciones al realizar una incubación extensa (50-52).
La resistencia de diferentes agentes
a la temperatura en S. maltophilia es otro de los factores
que prolongan el debate sin fin acerca de la validez de las pruebas
de sensibilidad con este microorganismo. En 1985, Wheat y cols. (55)
encontraron diferencias significativas en los resultados de sensibilidad
de S. maltophilia cuando las pruebas se realizaron a 30 ºC,
en comparación con los habituales 37 ºC, para los aminoglicósidos
y la polimixina B, hecho que no sucedía con P. aeruginosa
ni Enterobacteriaceae. Posteriormente Wilcox y cols. (56) establecieron
una fuerte correlación entre las alteraciones en los perfiles
de las OMP y la resistencia dependiente de la temperatura a la gentamicina.
Más tarde, y en sucesivas publicaciones a lo largo de la última
década, Rahmati-Bahram y cols. (57) relacionaron la disminución
de la sensibilidad a 30 ºC con cambios en la conformación
de la membrana externa de la bacteria, concretamente en la estructura
del lipopolisacárido (LPS), en relación con un mayor
contenido en antígeno O y una variación en el contenido
de fosfatos del LPS, sitio de unión más importante para
los aminoglicósidos. La combinación de estos dos hechos
daría lugar al efecto dependiente de la temperatura para estos
agentes (21, 57, 58).
Tampoco las nuevas quinolonas, antimicrobianos
llamados a sustituir a los tratamientos clásicos en S. maltophilia,
se han visto libres de este efecto. Dicha dependencia se demostró
en primer lugar con ciprofloxacino y trovafloxacino, con incrementos
en la CMI entre 2 y 16 veces el valor obtenido a 37 ºC, y posteriormente
también con norfloxacino, moxifloxacino y levofloxacino, siendo
moxifloxacino el agente con mayor número de cepas (35%) que
variaron en más de dos veces la CMI a 30 ºC. Las curvas
de muerte bacteriana (para ciprofloxacino, trovafloxacino y moxifloxacino)
demostraron una importante disminución (aproximadamente 2 log)
en el recuento de unidades formadoras de colonias por mililitro (UFC/ml)
cuando las pruebas se realizaron a baja temperatura (59, 60).
Recientemente han retomado el estudio
de este efecto Howe y cols. (61) estudiando 31 antimicrobianos, y
han encontrado diferencias en la sensibilidad a 30 ºC con colistina
(incrementos de 4 a 8 veces el valor de CMI a 35 ºC), quinolonas
y aminoglicósidos (de 2 a 8 veces) y macrólidos (2 a
4 veces), y un efecto mínimo con betalactámicos, cloranfenicol,
tetraciclinas, rifampicina, fosfomicina y vancomicina. Con cotrimoxazol
no se halló ninguna diferencia.
Algunos de estos autores proponían
que, debido a que en diferentes infecciones causadas por S. maltophilia,
como "shock" septicémico, lesiones en la piel o en la cavidad
peritoneal de pacientes sometidos a diálisis, podemos encontrarnos
con estas bajas temperaturas, la determinación de la sensibilidad
a los aminoglicósidos debería realizarse a 30 ºC
(21, 56, 57). Estos hechos ponen de manifiesto las importantes consideraciones
clínicas que habrían de tomarse en torno a la resistencia
mediada por la temperatura.
Alternativas a las pruebas clásicas
de sensibilidad para agentes eficaces
frente a S. maltophilia
El objetivo principal de las pruebas
de sensibilidad es orientarnos acerca del tratamiento óptimo
para un agente infeccioso. Debido a los problemas que presenta esta
práctica con S. maltophilia, la falta de consenso entre
investigadores a la hora de llevarlas a cabo y las consideraciones
que engloba el obtener un valor de CMI, determinado a concentraciones
fijas, sobre cultivo estático, etc., lo más conveniente
es recurrir a las opciones que los modelos experimentales, tanto in
vitro como in vivo, pueden aportar a la hora de valorar
a los antimicrobianos que deben emplearse en estas infecciones.
Con la aplicación de las curvas
de muerte bacteriana, que obedecen a criterios de reducción
de inóculo, podemos observar los posibles recrecimientos del
microorganismo durante las pautas más usuales de administración
de los antibióticos. En general está técnica
ha estado asociada a la identificación de sinergismos y son
contadas las ocasiones en que se han aplicado con la finalidad de
completar la valoración de actividad que ofrecen las pruebas
clásicas. Así, Pankuch y cols. (49) observaron a las
seis horas reducciones en el número de UFC/ml en más
de 2 log con ticarcilina-ácido clavulánico a concentraciones
de 16/2 mg/l. A las 24 horas, para reducir estos 2 log la concentración
se incrementa considerablemente hasta 128 mg/l, lo que indica fuertes
recrecimientos; igualmente ocurrió con piperacilina-tazobactam
y ciprofloxacino.
Las curvas de muerte bacteriana tienen
especial importancia a la hora de valorar con mayor exactitud tratamientos
alternativos a los ya conocidos para S. maltophilia. Un claro
ejemplo sería la actividad sinérgica de aztreonam y
ácido clavulánico (proporción 2:1), que ofrece
reducciones importantes del inóculo inicial tras dos horas
de comenzar el ensayo a dos veces la CMI. Con esta metodología
se ha podido determinar (62) que la concentración de ácido
clavulánico desciende más rápidamente que la
de aztreonam, y el sinergismo se pierde rápidamente, por lo
que los propios autores advierten de la limitación del uso
de esta asociación.
Bonfiglio y cols. (63) demostraron
la actividad bactericida de levofloxacino (más de 3 log10
de reducción del inóculo inicial, a 2 mg/l) y la compararon
con la escasa actividad de ofloxacino y ciprofloxacino, con los cuales
se evidenciaron además fuertes recrecimientos a las 24 horas
del ensayo, en todas las cepas estudiadas. Cohn y Waites (64) hicieron
lo propio sobre cepas con unas CMI de gatifloxacino de 0,125, 1 y
2 mg/l, demostrando su actividad bactericida a las tres horas a dos
y a cuatro veces la CMI. En ningún caso se observaron recrecimientos
a las 24 horas con concentraciones superiores a la CMI. Estos resultados
son similares a los comunicados por Howe y Macgowan (65), que situaron
a moxifloxacino y levofloxacino como las quinolonas más activas
frente a S. maltophilia, pero a diferencia de los trabajos
anteriores observaron recrecimientos a las 24 horas de iniciar el
estudio. Esta tendencia fue constatada también por Visalli
y cols. (66) con levofloxacino y trovafloxacino, lo que demostraba
la rápida aparición de resistencia a las modernas fluoroquinolonas
en S. maltophilia, por lo que recomendaron que el uso en monoterapia
de estos agentes debe ir acompañado de un aumento en su frecuencia
de administración.
Otro tipo de metodología que
puede aportar resultados mas precisos que la CMI es la actividad bactericida
del suero, que consigue integrar los datos farmacocinéticos
con los estudios de sensibilidad. Lemmen y cols. (67) determinaron
la actividad desarrollada por meropenem, ceftazidima y ciprofloxacino
en seis pacientes, encontrando que dosis de 2 g de ceftazidima y de
400 mg de ciprofloxacino mostraban una limitada actividad frente a
cepas de S. maltophilia sensibles, pero al aumentar las dosificaciones
hasta los máximos tolerados tenían una actividad improvisada
(100% de erradicación para ceftazidima y ciprofloxacino a 160
mg/l y 5 mg/l, respectivamente), mientras que el meropenem no mostró
actividad alguna.
De todas formas, con la aplicación
de modelos de simulación farmacodinámica se supera ampliamente
la valoración de la actividad que pueden ofrecernos las alternativas
habituales a las pruebas clásicas de sensibilidad. Con estos
ensayos podemos modificar las concentraciones del antimicrobiano,
adaptándolas a las que se van alcanzando en el lugar de la
infección a lo largo del tiempo, y con ello aproximar al máximo
las condiciones de estudio al medio in vivo. Garrison y cols.
(53) demostraron, con las dosis habitualmente usadas de ciprofloxacino
(2 dosis), ceftazidima (3 dosis), gentamicina (3 dosis) y ticarcilina-ácido
clavulánico (4 dosis), durante un periodo de 24 horas de administración,
una reducción del inóculo inicial de al menos 2 log,
aunque el recrecimiento ocurrió rápidamente, igualando
o superando al inóculo inicial a las 24 horas de la simulación.
La excepción fue ticarcilina-ácido clavulánico,
que no excedió un recuento de 106 UFC/ml tras el
recrecimiento en ninguna de las cepas ensayadas. Con una cepa sensible
a levofloxacino obtuvieron resultados similares. Estos hallazgos se
correlacionaron con una rápida emergencia de mutantes in
vivo e in vitro que originan aumentos en los valores de
la CMI con respecto de la cepa madre con todas las clases de agentes
bactericidas. Por ello propusieron que el uso de estos antimicrobianos
como terapia única debe de ser desestimado.
En general, la mayoría de los
autores de todos estos trabajos señalan la necesidad de valorar
los posibles recursos terapéuticos, bien en monoterapia o en
combinación, en animales de experimentación, resultados
que sin lugar a dudas serán esperados con expectación.
El problema del uso de la experimentación animal con S.
maltophilia se refleja en el único trabajo conocido al
respecto (68), que demuestra la actividad sinérgica de cefoperazona
en asociación con sulbactam en un modelo de neumonía.
Posiblemente la dificultad para realizar este tipo de investigación
queda patente en la propia dificultad que encontramos para diferenciar
entre infección y colonización por S. maltophilia
en el ser humano, y mas aún para poder reproducirlo en animales
de experimentación (5).
En resumen, los resultados obtenidos
con estos métodos contrastan en gran medida con las buenas
expectativas de tratamiento que ofrecen diversos antimicrobianos cuando
son ensayados por diferentes métodos clásicos, y quizá
sean estas alternativas para la valoración de un antimicrobiano
las más apropiadas, dados los frecuentes fallos terapéuticos
encontrados con el microorganismo.
SINERGISMOS
Es muy difícil extraer conclusiones
de las diferentes asociaciones identificadas como sinérgicas
in vitro, debido a las distintas metodologías empleadas
para su determinación. Además, en muchas ocasiones el
sinergismo se detecta por una técnica ("tablero de ejedrez"
en caldo o agar) y posteriormente no es demostrable mediante otras
(curvas de muerte bacteriana).
Por otro lado, son contados los estudios
que utilizan estas asociaciones en la práctica clínica,
por lo que no contamos con datos suficientes acerca de su eficacia
(6). Por este motivo, y con la finalidad de evitar sinergismos entre
agentes que no alcanzan las concentraciones séricas requeridas,
solamente nos detendremos (Tabla 3) en las asociaciones sinérgicas
confirmadas recientemente mediante las curvas de muerte bacteriana,
por considerarla la técnica más acertada y que mayor
información nos puede aportar.
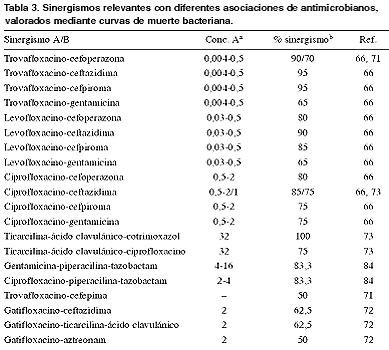
a,bConcentración del
antimicrobiano A y porcentaje de aislamientos en que se observó
sinergismo mediante la aplicación de curvas de muerte bacteriana.
En la mayoría de las asociaciones
se incorpora una quinolona como base de la asociación. Visalli
y cols. (66) y Steele-Moore y cols. (69) lo hicieron frente a 20 y
10 cepas, respectivamente, con trovafloxacino, levofloxacino y ciprofloxacino
en asociación con cefalosporinas de tercera y cuarta generación,
observando un efecto aditivo en las cepas en que no se observó
sinergismo. El gatifloxacino también ha mostrado importantes
propiedades sinérgicas con determinados agentes, como ceftazidima,
ticarcilina-ácido clavulánico y aztreonam, pero no así
con otros como la minociclina (70).
Poulos y cols. (71) observaron que
aparecía sinergismo incluso a elevados valores de CMI de ciprofloxacino,
excepto cuando ésta era 32 mg/l. En general, las asociaciones
más eficaces de su estudio fueron ticarcilina-ácido
clavulánico y cotrimoxazol. Estos resultados están en
la línea de los recientemente comunicados utilizando "tablero
de ejedrez" en caldo con trovafloxacino asociado a ceftazidima, cefepima
o cefoperazona (sinergismo total o parcial en el 80% de las cepas)
(72). Mediante estas técnicas, diferentes a las curvas de muerte
bacteriana, y en cepas de S. maltophilia multirresistentes,
se han descrito incrementos en la actividad y disminución de
las cepas resistentes a clinafloxacino y cotrimoxazol en asociación
con polimixina o rifampicina (4 mg/l en ambos casos). Aunque con polimixina
B los resultados fueron menos espectaculares, con rifampicina se incrementó
el número de cepas sensibles a meropenem (3%-29%), cefepima
(0%-34%), piperacilina (0%-60%) y ciprofloxacino (8%-26%) (73). Muñoz
y cols. (74) determinaron también que la actividad bactericida
del cotrimoxazol en asociación con polimixina B se incrementaba
notablemente cuando la concentración de esta última
era cercana a la CMI del microorganismo, sobre cepas de S. maltophilia
multirresistentes, sensibles y resistentes al cotrimoxazol.
La necesidad de encontrar estrategias
de tratamiento diferentes a las actitudes clásicas seguidas
con el patógeno se ha puesto de manifiesto recientemente. Giacometti
y cols. (75) demostraron la rápida eliminación (10 a
30 minutos) de S. maltophilia en presencia de péptidos
activos frente a la membrana (buforina II, cecropina P1, magainina
II). Además, estos péptidos, en rangos de 0,5 a 16 mg/l,
han demostrado su efecto sinérgico con piperacilina, ceftazidima,
meropenem, claritromicina y polimixina E (76). May y cols. (76) estudiaron
aceites esenciales derivados de la planta del té, que mostraron
una rápida actividad bactericida.
TRATAMIENTO EFICAZ
DE S. MALTOPHILIA
Con las premisas anteriormente definidas
y los perfiles de sensibilidad mostrados por los aislamientos caracterizados
molecularmente, la selección de antimicrobianos eficaces no
varía en esencia de la señalada por Dentor y Kerr en
su completa revisión (1). En general, S. maltophilia
demuestra una escasa sensibilidad a los aminoglicósidos y betalactámicos,
aunque las asociaciones de estos últimos con inhibidores de
betalactamasas aumentan su actividad. Las asociaciones con ácido
clavulánico son las más activas in vitro, en
especial ticarcilina-ácido clavulánico, que además
de potente es sinérgica a concentraciones terapéuticas
de ambos agentes (41). Son muchas las asociaciones con inhibidores
de betalactamasas que se han ensayado frente a S. maltophilia
(1), pero ninguna ha demostrado una actividad similar a la de ticarcilina-ácido
clavulánico. Cefepima-ácido clavulánico recientemente
ha demostrado ser una asociación sinérgica frente a
un mayor número de aislamientos que ticarcilina-ácido
clavulánico, con un porcentaje de cepas resistentes inferior
al de esta ya clásica asociación (77, 78). Al igual
que en el caso de ticarcilina-ácido clavulánico, el
incremento de la actividad ha de pasar por la menor capacidad de hidrólisis
de la betalactamasa L1 sobre agentes como la ticarcilina o la cefepima
(41). De todos modos, es necesario llevar a cabo estudios farmacodinámicos
que demuestren con mayor certeza su aplicación terapéutica.
Los macrólidos, a pesar de presentar
una reducida actividad, no deben descartarse debido a su papel en
la inhibición de la formación de biopelícula
en S. maltophilia (79). Las nuevas fluoroquinolonas, con una
actividad incrementada sobre sus predecesoras ciprofloxacino y norfloxacino,
mantienen las expectativas de utilización de este grupo de
antimicrobianos en el tratamiento de las infecciones por S. maltophilia.
Howe y cols. (65), en una revisión de la literatura (113 casos),
revelaron que la eficacia clínica del cotrimoxazol (79%, 34/43
pacientes) fue comparable a la de las quinolonas (92%, 12/13 pacientes).
La mayoría de los pacientes recibieron ciprofloxacino, y teniendo
en cuenta estos hechos sugieren que las nuevas quinolonas, especialmente
levofloxacino y moxifloxacino, podrían tener en el futuro una
importancia determinante. El caso es que, en este estudio, el número
de pacientes tratados con quinolonas es muy escaso y no es posible
extraer conclusiones definitivas. En algunos estudios ha quedado confirmada
la potente actividad de estos agentes, mientras que en otros aparecen
recrecimientos al utilizar monoterapia (65, 66). Como ya se ha comentado,
para definir adecuadamente las propiedades de estos fármacos
en su acción inhibitoria frente al patógeno, los modelos
de simulación in vitro, tal y como hicieron Garrison
y cols. (53), han de servirnos como una óptima alternativa
para su valoración. El cotrimoxazol es, por norma general,
la asociación que presenta mayor actividad in vitro
frente a S. maltophilia, pero siempre demostrada mediante las
pruebas clásicas, sin que existan evidencias que lo confirmen
por otros métodos.
Vartivarian y cols. (80), en su estudio
que integraba aislamientos desde 1981 a 1992, determinaron un incremento
secuencial de la resistencia de S. maltophilia a ciprofloxacino
y ticarcilina-ácido clavulánico, especialmente en el
caso de ciprofloxacino, debido al cambio de mentalidad en el tratamiento
de los pacientes con algún tipo de cáncer en detrimento
del cotrimoxaxol, lo que se tradujo en una disminución de la
resistencia a este agente. Fass y cols. (4), en su estudio de cinco
años, demostaron que el cotrimoxazol fue el único agente
que mantuvo una actividad cercana al 90%, con escasas variaciones
a lo largo del estudio. Por el contrario, estas oscilaciones eran
más marcadas para ticarcilina-ácido clavulánico
(70%-85%) y ceftazidima (50%- 70%), que aumentan o disminuyen en los
diferentes años del estudio. Más recientemente, según
los datos de vigilancia electrónica (TSN Base data-USA)
de sensibilidad de S. maltophilia, procedentes de 229 centros
que agrupan los aislamientos obtenidos durante quince meses (1998-1999)
(n = 1211-3825), revelan que el cotrimoxaxol continúa siendo
el agente con mayor actividad frente a dicho microorganismo (sensibilidad
del 98,7%), muy por encima de ceftazidima (43,5%), piperacilina-tazobactam
(55,7%) y gentamicina (16,1%). El levofloxacino ofrece importantes
expectativas, al ser sensibles un 78,2% de las cepas. Estos resultados
son similares a los de otro estudio de vigilancia (81) que incluye
27 centros (n = 123), realizado en un periodo de tres meses (1999),
aunque con ligeras variaciones en cuanto a la sensibilidad a ceftazidima
y piperacilina-tazobactam. En este caso, cotrimoxaxol (94,3%) y levofloxacino
(88,6%) muestran una actividad similar (81).
Vartivarian y cols. (80), en su estudio
que integraba aislamientos desde 1981 a 1992, determinaron un incremento
secuencial de la resistencia de S. maltophilia a ciprofloxacino
y ticarcilina-ácido clavulánico, especialmente en el
caso de ciprofloxacino, debido al cambio de mentalidad en el tratamiento
de los pacientes con algún tipo de cáncer en detrimento
del cotrimoxaxol, lo que se tradujo en una disminución de la
resistencia a este agente. Fass y cols. (4), en su estudio de cinco
años, demostaron que el cotrimoxazol fue el único agente
que mantuvo una actividad cercana al 90%, con escasas variaciones
a lo largo del estudio. Por el contrario, estas oscilaciones eran
más marcadas para ticarcilina-ácido clavulánico
(70%-85%) y ceftazidima (50%- 70%), que aumentan o disminuyen en los
diferentes años del estudio. Más recientemente, según
los datos de vigilancia electrónica (TSN Base data-USA)
de sensibilidad de S. maltophilia, procedentes de 229 centros
que agrupan los aislamientos obtenidos durante quince meses (1998-1999)
(n = 1211-3825), revelan que el cotrimoxaxol continúa siendo
el agente con mayor actividad frente a dicho microorganismo (sensibilidad
del 98,7%), muy por encima de ceftazidima (43,5%), piperacilina-tazobactam
(55,7%) y gentamicina (16,1%). El levofloxacino ofrece importantes
expectativas, al ser sensibles un 78,2% de las cepas. Estos resultados
son similares a los de otro estudio de vigilancia (81) que incluye
27 centros (n = 123), realizado en un periodo de tres meses (1999),
aunque con ligeras variaciones en cuanto a la sensibilidad a ceftazidima
y piperacilina-tazobactam. En este caso, cotrimoxaxol (94,3%) y levofloxacino
(88,6%) muestran una actividad similar (81).
En España la situación
es parecida (82). Durante un periodo de siete años (1993-1999)
se observa una importante disminución de la resistencia de
S. maltophilia al cotrimoxazol (del 16,8% al 4,7%), relacionado
posiblemente con la disminución en su uso a lo largo de estos
últimos cinco años. Es evidente, del mismo modo, un
importante incremento en la resistencia al ciprofloxacino (54% en
1993-1994 a 68,7% en los últimos tiempos) y el norfloxacino
(68,3% a 80,7%), que al parecer va unido a un aumento en la prescripción
hospitalaria de estas dos quinolonas. La sensibilidad al resto de
los agentes a lo largo de todo el periodo estudiado no ofreció
ninguna variación. Aunque en general se defiende que la práctica
terapéutica modifica el patrón de sensibilidad de S.
maltophilia (80), existen tendencias recientes que no apuntan
en la misma dirección. Se trata de un patógeno ampliamente
diseminado, que se encuentra en el suelo, el agua y la rizosfera vegetal,
y se cree que la transmisión a partir de estos enclaves es
determinante, dada la gran diversidad de cepas encontradas en el ambiente
hospitalario (83). Este particular microambiente es rico en nutrientes
y la competencia entre las diversas especies bacterianas es muy alta,
especies que al igual que S. maltophilia son productoras de
antibióticos, frente a los cuales desarrollan múltiples
mecanismos de resistencia a fin de incrementar su competitividad.
Lo cierto del caso es que, aunque no está nada claro el origen
de la resistencia del microorganismo, el cotrimoxaxol ha demostrado
ser la asociación más activa, tanto en las cepas ambientales
como en las hospitalarias (Fig. 3) (39).
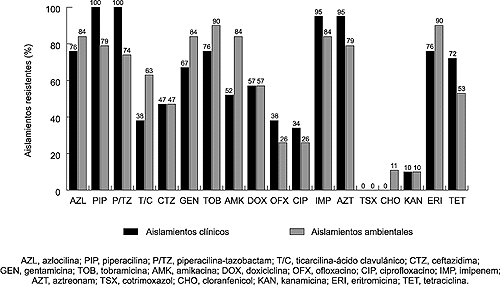
Figura 3. Perfil de resistencia
de aislamientos clínicos y ambientales de S. maltophilia
(39).
En resumen, todos estos hechos, unidos
a la buena predicción de eficacia que podemos obtener con los
diferentes métodos in vitro, convierten al cotrimoxaxol
en el agente predilecto para las infecciones por S. maltophilia.
Además, la mortalidad es menor en los pacientes que lo reciben
como antimicrobiano de elección (24%), en comparación
con los que no lo reciben (34%) (6). A pesar de ello, no siempre su
actividad antimicrobiana in vitro se correlaciona con su eficacia
clínica, probablemente por su falta de actividad bactericida
sobre el microorganismo, hecho que será causa de fallos clínicos
(1, 76).
Así, con los resultados in
vivo e in vitro (53), que demuestran la rápida emergencia
de fenotipos de resistencia múltiple, y las desafortunadas
respuestas clínicas encontradas con la monoterapia antibacteriana
(1), se propone el uso de asociaciones de dos o incluso tres agentes
para el tratamiento de las infecciones por S. maltophilia,
y a las máximas dosis toleradas, destacando principalmente
cotrimoxaxol, minociclina, ticarcilina-ácido clavulánico
o cefalosporinas de tercera generación (6, 69, 80). La prevención
en la transmisión de este microorganismo y la prudente aplicación
de la antibioticoterapia son las principales medidas de control de
las infecciones por S. maltophilia (82).
AGRADECIMIENTOS
S. Valdezate disfruta de una beca de
formación de personal investigador (2114/98) de la Consejería
de Educación y Ciencia de la Comunidad de Madrid.
Para correspondencia: Dra. Mª
Luisa Gómez-Lus, Departamento de Microbiología I, Facultad
de Medicina, Universidad Completense de Madrid, Avda. Complutense
s/n, 28040 Madrid. Tfno. 91 394 15 11. e-mail: [email protected]
BIBLIOGRAFÍA
- Denton, M., Kerr, K.G. Microbiology and clinical
aspects of infection associated with Stenotrophomonas maltophilia.
Clin Microbiol Rev 1998; 11: 57-80.
- Julve, R., Rovira, E., Belda, A. y cols. Espectro
clínico de la infección por Stenotrophomonas (Xanthomonas)
maltophilia. Ann Med Int 1998; 15: 476-480.
- Villarino, M.E., Stevens, L.E., Schable, B. y cols.
Risk factors for epidemic Xanthomonas maltophilia infection/colonization
in intensive care unit patients. Infect Control Hosp Epidemiol
1992; 13: 201-206.
- Fass, R.J., Barnishan, J., Solomon, M.C., Ayers,
L.W. In vitro activities of quinolones, b-lactams,
tobramycin, and trimethoprim-sulfamethoxazole against nonfermentative
gram-negative bacilli. Antimicrob Agents
Chemother 1996; 40: 1412-1418.
Gopalakrishnan, R., Hawley, H.B.,
Czachor, J.S., Markert, R.J., Bernstein, J.M. Stenotrophomonas
maltophilia infection and colonization in the intensive care units
of two community hospitals: A study of 143 patients. Heart Lung
1999; 28: 134-141.
- Muder, R.R., Harris, A.P., Muller, S. y cols. Bacteriemia
due to Stenotrophomonas (Xanthomonas) maltophilia: A prospective,
multicenter study of 91 episodies. Clin Infect Dis 1996; 22:
508-512.
- Cystic Fibrosis Foundation. National CF Patient
Registry 1999. Annual Data Report, Bethesda, MD 2000.
- Gilligan, P. Report on the consensus document
for microbiology and infectious diseases in cystic fibrosis.
Clin Microbiol Newsletter 1996; 18: 83-87.
- Valdezate, S., Vindel, A., Maiz, L., Baquero, F,
Escobar, H., Cantón, R. Persistence and variability of
Stenotrophomonas maltophilia in a cystic fibrosis patients, Madrid
1991-1998. Emerg Infect Dis 2001; 7: 113-122.
- Demko, C.A., Stern, R.C., Doershuk, C.F. Stenotrophomonas
maltophilia in cystic fibrosis: Incidence and prevalence. Pediatr
Pulmonol 1998; 25: 304-308.
- Goss, C.H., Aitken, M.L., Johnson, W.C., Campbell,
P.W., Rubenfeld, G.D. Acquiring Stenotrophomonas maltophilia
does not decrease survival in patients with cystic fibrosis.
Pediatric Pulmonol 1999; 19 (Suppl. 1): Abstr. 334-335.
- Schable, B., Rhoden, D.L., Jarvis, W.R., Miller,
J.M. Prevalence of serotypes of Xanthomonas maltophilia from
world-wide sources. Epidemiol Infect 1992; 108: 337-341.
- Orr, K., Gould, F.K., Sisson, P.R., Lightfoot,
N.F., Freeman, R., Burdess, D. Rapid inter-strain comparison
by pyrolysis mass spectrometry in nosocomial infection with Stenotrophomonas
maltophilia. J Hosp Infect 1991; 17: 187-195.
- Wüst, J., Frei, R., Gunthard, H., Altwegg,
M. Analysis of restriction fragment length polymorphism and ribotyping
of multirresistant Stenotrophomonas maltophilia isolated from persisting
lung infection in a cystic fibrosis patient. Scand J Infect
Dis 1995; 27: 499-502.
- Gerner-Smidt, P., Bruun, B., Arpi, M., Schmidt,
J. Diversity of nosocomial Xanthomonas maltophilia (Stenotrophomonas
maltophilia) as determined by ribotyping. Eur J Microbiol Infect
Dis 1995; 14: 137-140.
- Bingen, E.H., Denamur, E., Lambert-Zechosvsky,
N.Y. y cols. DNA restriction fragment polymorphism differentiates
crossed from independent infections in nosocomial Xanthomonas maltophilia
bacteremia. J Clin Microbiol 1991; 29: 1348-1350.
- Talon, D., Bailly, P., Leprat, R. y cols. Typing
of hospital strains of Xanthomonas maltophilia by pulse-field gel
electrophoresis. J Hosp Infect 1994; 27: 209-217.
- Laing, F.P.Y, Ramotar, K., Read, R.R. y cols. Molecular
epidemiology of Xanthomonas maltophilia colonization and infection
in the hospital environment. J Clin Microbiol 1995; 33:513-518.
- Yao, J.D.C., Conly, J.M., Krajden, M. Molecular
typing of Stenotrophomonas (Xanthomonas) maltophilia by DNA macrorestriction
analysis and ramdom amplified polymorphic DNA analysis. J Clin
Microbiol 1995; 33: 2195-2198.
- Hauben, L., Vauterin, L., Moore, E.R.B., Hoste,
B. Swings, J. Genomic diversity of the genus Stenotrophomonas.
Int J Syst Bacteriol 1999; 49: 1749-1760.
- Rahmati-Bahram, A., Magee, J.T., Jackson, S.K.
Temperature-dependent aminoglycoside resistance in Stenotrophomonas
(Xanthomonas) maltophilia, alterations in protein and lipopolysaccharide
with growth temperature. J Antimicrob Chemother 1996; 37: 665-676.
- Alonso, A., Martínez, J.L. Multiple antibiotic
resistance in Stenotrophomonas maltophilia. Antimicrob Agents
Chemother 1997; 41: 1140- 1142.
- Zhang, L., Li, X.Z., Poole, K. Multiple antibiotic
resistance in Stenotrophomonas maltophilia: Involvement of a multidrug
efflux system. Antimicrob Agents Chemother 2000; 44: 287-293.
- Alonso, A., Martínez, J.L. Cloning and
characterization of SmeDEF, a novel multidrug efflux pump, from
Stenotrophomonas maltophilia. Antimicrob Agents Chemother 2000;
44: 3079-3086.
- Alonso, A., Martínez, J.L. Expression
of multidrug efflux pump SmeDEF by clinical isolates of Stenotrophomonas
maltophilia. Antimicrob Agents Chemother 2001; 45: 1879-1881.
- Denton, M., Kerr, V., Hawkey, P.M. Correlation
between genotype and b-lactamases of
clinical and environmental strains of Stenotrophomonas maltophilia.
J Antimicrob Chemother 1998; 43: 555-558.
- Paton, R., Miles, R.S., Amyes, S.G.B. Biochemical
properties of inducible b-lactamases
from Xanthomonas maltophilia. Antimicrob
Agents Chemother 1994; 38: 2143-2149.
- Saino, Y., Inoue, M., Mitsuhashi, S. Purification
and properties of an inducible cephalosporinase from Pseudomonas
maltophilia. Antimicrob Agents Chemother 1984; 25: 362-365.
- Avison, M.B., Higgins, C., von Heldreich, C.J., Bennett,
P.M., Walsh, T.R. Plasmid location and molecular heterogeneity
of the L1 and L2 b-lactamase genes of
Stenotrophomonas maltophilia. Antimicrob
Agents Chemother 2001; 45: 413-419.
- Walsh, T.R., Hall, L., Assinder, S.J. y cols. Sequence
analysis of the L1 metallo-b-lactamase
from Xanthomonas maltophilia. Biochim Biophys
Acta 1994; 1218: 199-201.
- Sanschagrin, F., Dufresne, J., Levesque, R.C. Molecular
heterogeneity of the L-1 metallo-beta-lactamase family from Stenotrophomonas
maltophilia. Antimicrob Agents Chemother 1998; 42: 1245-1248.
- Roster, S., Mett, H. Physiological studies of
the regulation of the b-lactamase
expression in Pseudomonas maltophilia. J Bacteriol 1989; 171:
483-487.
- Avison, M.B., Ford, P.J., Walsh, T.R., Bennett, P.M.
The L1 and L2 b-lactamase genes of
Stenotrophomonas maltophilia are regulated independently.
40th Interscience Conference on Antimicrobial Agents and Chemotherapy,
Toronto, Canada 2000; Abstr. 1921.
- Avison, C., von Heldreich, M.B., Higgins, C.J., Bennett,
P.M., Walsh, T.R. A TEM-2-b-lactamase
encoded on an active Tn1-like transposon in the genome of a clinical
isolate of Stenotrophomonas maltophilia.
J Antimicrob Chemother 2001; 46: 879-884.
- Lambert, T., Ploy, M.C., Denis, F., Courvalin,
P. Characterization of the chromosomal aac(6´)-Iz gene of
Stenothrophomonas malthophilia. Antimicrob Agents Chemother
1999; 43: 2366-2361.
- Alonso, A., Sánchez, P., Martínez,
J.L. Stenotrophomonas maltophilia. DR457R contains a cluster
of genes from gram-positive bacteria involved in antibiotic and
heavy metal resistance. Antimicrob Agents Chemother 2000; 44:
1778-1782.
- Hooper, D.C. Mechanism of quinolone resistance.
Drug Resistance Update 1999; 2: 38-55.
- Valdezate, S., Echeíta, A., Vindel, A.,
Baquero, F., Cantón, R. Mutations in quinolone-resistant
determining region (QRDR) of gyrA gene in Stenotrophomonas maltophilia
clinical isolates. 40th Interscience Conference on Antimicrobial
Agents and Chemotherapy, Toronto, Canada 2000; Abstr. 1036.
- Berg, G., Roskot, N., Smalla, K. Genotypic and
phenotypic relationships between clinical and environmental isolates
of Stenotrophomonas maltophilia. J Clin Microbiol 1999; 37:
3594-3600.
- Valdezate, S., Vindel, A., Loza, E., Baquero, F.,
Cantón, R. Antimicrobial susceptibilities of unique Stenotrophomonas
maltophilia clinical strains. Antimicrob Agents Chemother 2001;
45: 1581-1584.
- Lecso-Bornet, M., Bergone-Bérézin,
E. Susceptibility of 100 strains of Stenotrophomonas maltophilia
to three b-lactams and five b-lactam-
b-lactamase inhibitor combinations. J Antimicrob
Chemother 1997; 40: 717-720.
- Muñoz-Bellido, J.L., Muñoz-Criado,
S., García-García, I., Alonso-Manzanares, M.A., Gutiérrez-Zufiaurre,
M.N., García-Rodríguez, J.A. In vitro activities
of b-lactam-b-lactamase inhibitor combinations
against Stenotrophomonas maltophilia:
Correlation between methods for testing inhibitory activity, time-kill
curves, and bactericidal activity. Antimicrob Agents Chemother
1997; 41: 2621-2615.
- Weiss, K., Restieri, C., Carolis, E., Laverdière,
M., Guay, H. Comparative activity of new quinolones against 326
clinical isolates of Stenotrophomonas maltophilia. J Antimicrob
Chemother 2000; 45: 363-365.
- Schmitz F.J., Sadurski R., Verhoef, J., Milatovic,
D., Fluit, A.C. Typing of 154 clinical isolates of Stenotrophomonas
maltophilia by pulsed-field gel electrophoresis and determination
of the in vitro susceptibilities of these strains to 28 antibiotics.
J Antimicrob Chemother 2000; 45: 919-931.
- Bonfiglio, G., Livermore, D.M. Effect of media
composition on the susceptibility of Xanthomonas maltophilia to
b-lactam antibiotics.
J Antimicrob Chemother 1991; 28: 837-842.
- Bonfiglio, G., Livermore, D.M. Zinc ions and medium-dependent
susceptibility to b-lactams in Xanthomonas
maltophilia. J Antimicrob Chemother 1994;
33: 181-183.
- Cooke, P., Heritage, J., Kerr, K., Hawkey, P.M.,
Newton, K.E. Different effect of zinc ions on in vitro susceptibilities
of Stenotrophomonas maltophilia to imipenem and meropenem. Antimicrob
Agents Chemother 1996; 40: 2909-2910.
- National Committee for Clinical Laboratory Standards.
Performance standards for antimicrobial susceptibility testing;
eight information supplement. Document M100-S7. NCCLS, Villanova,
PA, USA 1998.
- Pankuch, G.A., Jacobs, M.R., Rittenhouse, S.F., Appelbaum,
P.C. Susceptibilities of 123 strains of Xanthomonas maltophilia
to eight b-lactams (including b-lactam-b-lactamase
inhibitor combinations) and ciprofloxacin tested by five methods.
Antimicrob Agents Chemother 1994; 38: 2317-2322.
- Yao, J.D.C., Louie, M., Louie, L., Goodfellow,
J., Simor, A.E. Comparison of E-test and agar dilution for antimicrobial
susceptibility testing of Stenotrophomonas (Xanthomonas) maltophilia.
J Clin Microbiol 1995; 33: 1428-1430.
- Traub, W.H., Leonhard, B., Bauer, D. Antibiotic
susceptibility of Stenotrophomonas (Xanthomonas) maltophilia: Comparative
(NCCLS criteria) evaluation of antimicrobial drugs with the agar
dilution and the agar disk diffusion (Bauer-Kirby) test. Chemotherapy
1998; 44: 164-173.
- Carrol, K.C., Cohen, S., Nelson, R. Comparison
of various in vitro susceptibility methods for testing Stenotrophomonas
maltophilia. Diag Microbiol Infect Dis 1998; 32: 229-235.
- Garrison, M.W., Anderson, D.E., Campbell, D.M.
y cols. Stenotrophomonas maltophilia: Emergence of multidrug-resistant
strains during therapy and in an in vitro pharmacodynamic chamber
model. Antimicrob Agents Chemother 1996; 40: 2859-2864.
- Wiles, T., Turng, B., Towns, V., Lilli, H., Wulff,
S. Comparative studies of antibiotic susceptibility of Stenotrophomonas
maltophilia with trimethoprim/sulfamethoxazole using different test
methodologies. Clin Microbiol Infect 1998; 5 (Suppl. 3): 370.
- Wheat, P.F., Winstanley, T.G., Spencer, R.C. Effect
of temperature on antimicrobial susceptibilities of Pseudomonas
maltophilia. J Clin Pathol 1985; 38: 1055-1058.
- Wilcox, M.H., Winstanley, T.G., Spencer, R.C. Outer
membrane protein of Xanthomonas maltophilia isolates displaying
temperature-dependent susceptibility to gentamicin. J Antimicrob
Chemother 1994; 33: 663-666.
- Rahmati-Bahram, A., Magee, J.T., Jackson, S.K.
Growth temperature-dependent variation of cell envelope lipids
and antibiotic susceptibility in Stenotrophomonas (Xanthomonas)
maltophilia. J Antimicrob Chemother 1995; 36: 317-326.
- Rahmati-Bahram, A., Magee, J.T., Jackson, S.K.
Effect of temperature on aminoglycoside binding sites in Stenotrophomonas
maltophilia. J Antimicrob Chemother 1997; 39: 19-24.
- Keen, S.L., Denton, M., Kerr, K.G. Temperature
susceptibility of Stenotrophomonas maltophilia to ciprofloxacin
and trovafloxacin. 21st Internacional Congress of Chemotherapy,
Birmingham, UK 1999; Abstr. P448.
- Fuentes, F., Sevillano, D., Alou, L., Bugella,
J.H., Laguna, B. Temperature-dependent susceptibility of Stenotrophomonas
maltophilia to quinolones. 3rd European Congress of Chemotherapy,
Madrid 2000. Rev Esp Quimioterap 2000; 13 (Supl. 2): Abstr. M155.
- Howe, R.A., Bowker, K.E., Wootton, M., Bennett,
P.M., Walsh, T.R., Macgowan, A.P. Selective temperature dependence
in susceptibility of 66 clinical strains of Stenotrophomonas maltophilia
(Sma) to 31 antimicrobials. 40th Interscience Conference on
Antimicrobial Agents and Chemotherapy, Toronto, Canada 2000; Abstr.
518.
- García-Rodríguez, J.A., García
Sánchez, J.E., Muñoz Bellido, J.L., García
García, M.I., García Sánchez, E. Kinetics
of antimicrobial activity of aztreonam/clavulanic acid (2:1) against
Xanthomonas maltophilia. J Antimicrob Chemother 1991; 27: 552-554.
- Bonfiglio, G., Cascone, C., Azzarelli, C., Cafio,
V., Marchetti, F., Stefani, S. Levofloxacin in vitro activity
and time-kill evaluation of Stenotrophomonas maltophilia clinical
isolates. J Antimicrob Chemother 2000; 45: 115-117.
- Cohn, M.L., Waites, K.B. Antimicrobial activities
of gatifloxacin against nosocomial isolates of Stenotrophomonas
maltophilia measured by MIC and time-kill studies. Antimicrob
Agents Chemother 2001; 45: 2126-2128.
- Howe, R.A., Macgowan, A.P. The susceptibility
of Stenotrophomonas maltophilia (SMA) to newer quinolones and their
potential role in therapy. 39th Interscience Conference on Antimicrobial
Agents and Chemotherapy, San Francisco, USA 1999; Abstr. 2279.
- Visalli, M.A., Jacobs, M.R., Appelbaum, P.C. Activities
of three quinolones, alone and in combination with extended-spectrum
cephalosporins or gentamicin, against Stenotrophomonas maltophilia.
Antimicrob Agents Chemother 1998; 42: 2002-2005.
- Lemmen, S.W., Häfner, H., Reinert, R.R., Zolldam,
D., Kummerer, K., Lütticcken, R. Comparison of serum bactericidal
activity of ceftazidime, ciprofloxacin and meropenem against Stenotrophomonas
maltophilia. J Antimicrob Chemother 2001; 47: 113-124.
- Rouse, M.S., Tallan, B.M., Henry, N.K., Steckelberg,
J.M., Wilson, W.R. Treatment of Xanthomonas maltophilia experimental
pneumonia. Chest 1991; 12 (Suppl.): 147S.
- Steele-Moore, L., Furness, K., Stark, K., Holloway,
W. Stenotrophomonas maltophilia time-kill curves with trovafloxacin
plus cefepime and trovafloxacin plus cefoperazone. 21st Internacional
Congress of Chemotherapy, Birmingham, UK 1999; Abstr. P144.
- Gradelski, E., Valera, L., Bonner, D., Fung-Tomc,
J. Sinergistic activity of gatifloxacin in combination with other
antimicrobial agents against Pseudomonas and related species.
40th Interscience Conference on Antimicrobial Agents and Chemotherapy,
Toronto, Canadá 2000; Abstr. 527.
- Poulos, C.D., Matsumura, S.O., Willey, B.M., Low,
D.E., McGeer, A. In vitro activities of antimicrobial combinations
against Stenotrophomonas (Xanthomonas) maltophilia. Antimicrob
Agents Chemother 1995; 39: 220-2223.
- Johnson, D.M., Jones, R.N., Pfaller, M.A. Antimicrobial
interactions of trovafloxacin and extended-spectrum cephalosporins
or azithromycin tested against clinical isolates of Pseudomonas
aeruginosa and Stenotrophomonas maltophilia. J Antimicrob Chemother
1998; 42: 557-559.
- Chin, N., Whittier, S., Della-Latta, P. In vitro
combination of polimyxin B and rifampin with beta-lactams, quinolones,
and TMP/SXT against Stenotrophomonas maltophilia. 39th Interscience
Conference on Antimicrobial Agents and Chemotherapy, San Francisco,
USA 1999; Abstr. 2280.
- Muñoz, J.L., García, M.I., Muñoz,
S., Leal, S., Fajardo, M., García-Rodríguez, J.A.
Activity of trimethoprim/sulfamethoxazole plus polymyxin B against
multiresistant Stenotrophomonas maltophilia. Eur J Clin Microbiol
Infect Dis 1996; 15: 879-882.
- Giacometti, A., Cirioni, O., Del Prete, M.S. y
cols. In vitro activities of membrane-active peptides alone and
in combination with clinically used antimicrobial agents against
Stenotrophomonas maltophilia. Antimicrob Agents Chemother 2000;
44: 1716-1719.
- May, J., Chan, C.H., King, A., Willians, L., French,
G.L. Time-kill studies of tea tree oils on clinical isolates.
J Antimicrob Chemother 2000; 45: 639-643.
- Cantón, R., Valdezate, S., Sánchez
del Sanz, B. y cols. Cefepime and betalactamase inhibitor combinations
against clinical isolates of Stenotrophomonas maltophilia. Clin
Microbiol Infect 1998; 5 (Suppl. 3): 379.
- Sevillano, D., Valero, E., García, R., Calvo,
A., Alou, L., Gómez-Lus, M.L. Actividad sinérgica
de cefepima-ácido clavulánico frente a aislamientos
clínicos de Stenotrophomonas maltophilia. Rev Esp Quimioterap
2001; 14 (Supl. 1): 190.
- Howe, R.A., Macgowan, A.P. The effect of macrolide
antibiotics on biofilm formation by Stenotrophomonas maltophilia.
21st International Congress of Chemotherapy, Birmingham, UK 1999;
Abstr. P129.
- Vartivarian, S., Anaissie, E., Bodey, G., Sprigg,
H., Rolston, K. A changing pattern of susceptibility of Xanthomonas
maltophilia to antimicrobial agents: Implications for therapy.
Antimicrob Agents Chemother 1994; 38: 624-627.
- Sahm, D.F., Critchley, I.A., Kelly, L.J. y cols.
Evaluation of current activities of fluoroquinolones against
gramnegative bacilli using centralized in vitro testing and electronic
surveillance. Antimicrob Agents Chemother 2001; 45: 267-274.
- Betriu, C., Sánchez, A., Palau, M.L., Gómez,
M., Picazo, J.J. Antibiotic resistanse surveillance of Stenotrophomonas
maltophilia, 1993- 1999. J Antimicrob Chemother 2001; 48: 141-156.
- Denton, M., Todd, N.J., Keer, K.G., Hawkey, P.M.,
Littlewood, J.M. Molecular epidemiology of Stenotrophomonas maltophilia
isolated from clinical specimens from patiens with cystic fibrosis
and associated enviromental samples. J Clin Microbiol 1998;
36: 1953-1958.
- Gould, I.M., Milne, K. In vitro pharmacodynamic
studies of piperacillin/tazobactam with gentamicin and ciprofloxacin.
J Antimicrob Chemother 1997; 39: 53-61.
|