- Como caracterización farmacocinética del proceso global de acumulación en el interior celular.
- Porque la mayor permanencia de un antibiótico en el interior de la célula se corresponde con un mayor tiempo para interaccionar con las bacterias intracelulares.
- Porque al ser los neutrófilos unas células móviles, el antibiótico acumulado en el interior podría transportarse hasta el lugar preciso de la infección.
Penetración de los antibióticos en los polimorfonucleares humanos, con especial referencia a las quinolonas
A. Orero1,2, E. Cantón1, J. Pemán2 y M. Gobernado2
1Unidad de Bacteriología Experimental y 2Servicio de Microbiología, Hospital Universitario La Fe, Avda. Campanar 21, 46009 Valencia
|
INTRODUCCIÓN En las relaciones entre microorganismo y huésped, los patógenos han adquirido diferentes estrategias para sobrevivir: unos se han adaptado a vivir exclusivamente en el interior de las células, los microorganismos intracelulares obligatorios, como Toxoplasma gondii, Mycobacterium leprae, Chlamydia psittaci, Chlamydia pneumoniae, Mycoplasma pneumoniae, Coxiella burnettii, Rickettsia spp., etc., que necesitan estar en el interior de una célula para vivir; otros, los intracelulares facultativos, como Mycobacterium tuberculosis, Brucella spp., Listeria spp., Legionella pneumophila, algunas especies de Salmonella y Staphylococcus aureus, que pueden residir tanto dentro como fuera de las células; y los microorganismos extracelulares, que cumplen su ciclo vital fuera de las células (1). Este último grupo está en continua revisión, y claro ejemplo de ello es el caso de Streptococcus pyogenes, que clásicamente se ha considerado extracelular pero recientemente se ha localizado en el interior de la célula, en procesos de faringitis crónica (2, 3). Los fagocitos son células especializadas en la lucha contra las infecciones bacterianas, y constituyen la primera línea de defensa del organismo frente a estos agentes externos. Los mecanismos microbicidas de estas células incluyen en primer lugar la fagocitosis o inclusión del microorganismo en el interior celular, y posteriormente los mecanismos bactericidas, dependientes del oxígeno (producción de radicales superóxido y peróxido de hidrógeno) e independientes de éste (enzimas hidrolíticas). Los microorganismos intracelulares, tanto obligatorios como facultativos, evaden la acción microbicida de los fagocitos por diferentes mecanismos. Unos inhiben la fusión del fagosoma con el lisosoma, por lo que las bacterias proliferan intracelularmente y sobreviven en los lisosomas (M. leprae) o en los fagosomas (M. tuberculosis, Chlamydia spp.); y otros producen toxinas, que causan exocitosis o rotura de la membrana del lisosoma o del fagosoma; otros producen enzimas inactivantes de los productos de oxidación del fagocito, como las catalasas, que desdoblan el peróxido de hidrógeno producido por los fagocitos en agua y oxígeno (S. aureus) (4). Dentro del fagocito, los microorganismos se localizan en diferentes lugares: unos lo hacen en el fagosoma o en el fagolisosoma, como S. aureus o Haemophilus influenzae; otros se localizan en el citosol, como Salmonella spp. o Rickettsia spp.; y algunos incluso son capaces de traspasar la membrana del fagosoma (Trypanosoma cruzei), aunque la mayoría de los microorganismos permanecen en el lisosoma (5-7). Desde el comienzo de la era antibiótica, numerosos investigadores han dirigido sus estudios hacia el conocimiento de la relación entre el antibiótico y el sistema inmunitario, llegando a proponer que los antibióticos son habitualmente menos efectivos para el tratamiento de las infecciones en ausencia de fagocitos funcionales, y que la presencia de antibióticos incrementa la fagocitosis y el efecto bactericida de los leucocitos humanos sin modificar su capacidad quimiotáctica (8-11). Los primeros estudios sobre la interacción de antibiótico, bacteria intracelular y fagocito dieron como resultado que las bacterias intracelulares que sobrevivian en el interior de los fagocitos estaban protegidas del efecto bactericida de la mayoría de los antibióticos hasta entonces conocidos (12-15). Mandell propuso en 1973 que este hecho tenía dos explicaciones: que la bacteria intracelular tuviera el metabolismo alterado y los antibióticos fueran inefectivos en ese estado, o que los antibióticos fueran incapaces de penetrar en el fagosoma. En sus estudios observó que la bencilpenicilina era inactiva frente a S. aureus fagocitado, mientras que la rifampicina mostraba actividad, por lo que llegó a la conclusión de que la incapacidad de la bencilpenicilina para actuar sobre las bacterias fagocitadas se debía, en parte, a la incapacidad de llegar al lugar de localización de la bacteria (16). A partir de los resultados de Mandell se abrió una toda una línea de investigación enfocada al estudio de la penetración y localización intracelular de los antibióticos. Pronto se llegó a la conclusión de que es fundamental que un antibiótico penetre y sea activo intracelularmente para poder erradicar las infecciones causadas por microorganismos localizados en el interior de la célula. Pero no sólo es importante para combatir este tipo de infecciones, sino porque existen numerosas situaciones patológicas en que el paciente presenta un déficit en las funciones propias de los fagocitos, unas veces congénitas, como es el caso de la enfermedad granulomatosa crónica, la enfermedad de Chediak-Higashi o el Síndrome de Job, y otras veces adquiridas, como en las enfermedades hematológicas o el sida, o las producidas por los tratamientos médicos o inmunosupresores que reciben, como ocurre en los enfermos receptores de trasplantes, sometidos a radioterapia o quimioterapia, etc. En este tipo de pacientes son frecuentes las infecciones recurrentes, producidas por microorganismos que en general son extracelulares y sensibles a los mecanismos bactericidas de los leucocitos, y que persisten en el interior del leucocito por la inmunodepresión, convirtiéndose el polimorfonuclear (PMN), en estos casos, en reservorio de microorganismos si el antibiótico no es capaz de penetrar y ser activo en el interior de la célula. Por todo ello es cada día más importante conocer la farmacocinética y la farmacodinamia intracelular de los antibióticos, los procesos de acumulación y su actividad intracelular, para completar los estudios habituales de las propiedades de los antibióticos in vitro.
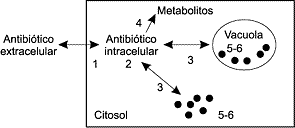
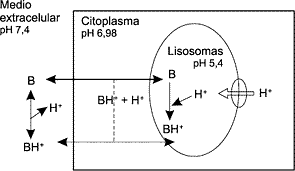
En la Fig. 1 se representan esquemáticamente las principales propiedades farmacocinéticas (penetración, localización subcelular y metabolismo) y farmacodinámicas (capacidad del antibiótico para actuar bajo las condiciones fisicoquímicas en su localización subcelular y estado metabólico de la bacteria) que son importantes para determinar la actividad intracelular de un antibiótico (17). El objetivo de este artículo es revisar los factores que influyen en la penetración de los antibióticos, los métodos que se utilizan para determinar la concentración intracelular y la caracterización de los mecanismos de penetración, y los datos publicados hasta ahora, con especial atención al grupo de las quinolonas. PARÁMETROS FISICOQUEMICOS QUE RIGEN LA PENETRACIÓN DE LOS ANTIBIITICOS EN LOS PMN La capacidad de un antibótico de penetrar y acumularse en el interior de la célula es una cuestión compleja, que depende de numerosos factores tanto físicos (peso molecular, constantes de disociación, liposolubilidad o unión a proteínas) como químicos (estructura básica, grupos radicales, estereoisometría, movilidad electrónica, etc.) (18). La lipofilia es la capacidad de una sustancia de solubilizarse en una fase oleosa, y se determina por el cociente entre la concentración en equilibrio de dicha sustancia en una fase acuosa y en otra oleosa. Dicho cociente se denomina "coeficiente de reparto" y se designa como P. Define, en parte, la capacidad de una molécula de atravesar la bicapa lipídica de la célula por difusión pasiva. Los antibióticos muy hidrófilos, como los betalactámicos, tienen dificultado el paso. Las quinolonas, que en general tienen una lipofilia moderada, son capaces de difundir a través de la bicapa lipídica. La mayor o menor lipofilia de las quinolonas determinará, en parte, su mayor o menor concentración intracelular. Otro parámetro fundamental es la naturaleza ácido-base de las moléculas, definida por Brönsted-Lowry como la capacidad de ceder o aceptar protones. La reacción de disociación o ionización de un ácido o una base, en disolución acuosa, viene caracterizada por una constante de disociación Ka. Esta constante, del mismo modo que el pH, se utiliza más en forma logarítmica, denominándose entonces pKa. Para entender su importancia en el proceso de penetración de un antibiótico hay que indicar primero que en el entorno fisiológico descrito existe un gradiente de pH: el pH del medio extracelular es de 7,0 a 7,4, en el interior de los PMN es de 6,98 y en el interior de los lisosomas es de 5,4 (19). Es bien conocido que las formas ionizadas de los ácidos y bases orgánicos débiles difunden más lentamente a través de las membranas biológicas que sus formas no ionizadas. Por ello, y por el gradiente de pH existente entre el exterior y el interior celular, las bases débiles suelen concentrarse y los ácidos débiles eluirse desde el interior celular, ya que los lisosomas son los compartimientos más ácidos de la célula, con un pH de alrededor de 5,4, que mantienen gracias a una bomba de protones. Es lógico predecir que las bases débiles se acumularán en el interior de estos orgánulos, ya que se ionizarán y verán impedido su paso a través de la membrana del lisosoma. Por el contrario, los ácidos débiles difunden a través de la membrana plasmática en su forma no ionizada, y no se acumulan, porque al continuar neutros en el interior celular difunden al exterior. Los betalactámicos son ácidos orgánicos, por lo que son capaces de atravesar la membrana plasmática, pero en el interior celular no son protonados y vuelven a salir, formando un equilibrio estable; por ello son capaces de penetrar, pero no de acumularse. Esto lo demostraron Renard y cols. en 1987 sintetizando un derivado básico de bencilpenicilina, que fue capaz de penetrar y acumularse en el interior celular a una concentración entre cuatro y cinco veces superior a la concentración extracelular (20). En la Fig. 2 se representa esquemáticamente lo expuesto.
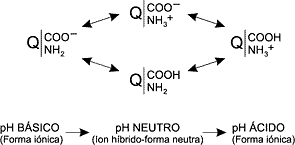
Figura 2. Mecanismo de acumulación propuesto para las bases orgánicas en el interior del citosol y de los lisosomas. Las membranas biológicas son más permeables a las formas no ionizadas de las bases orgánicas débiles (B) que a las formas ionizadas (BH+). Los lisosomas contienen una bomba de transporte de protones en contra de gradiente, lo que permite que el pH en su interior sea inferior al pH citoplasmático. Por ello, las bases orgánicas tienden a concentrarse en los lisosomas, y en menor grado en el citosol, debido al pH. Por el contrario, los ácidos orgánicos débiles, que son más liposolubles en su forma no ionizada que en su forma ionizada, tienden a ser excluidos del interior celular (20). Las quinolonas son moléculas de naturaleza anfotérica, ya que todas ellas poseen un grupo carboxílico de carácter ácido y un grupo amino de carácter básico. Las constantes de disociación de las quinolonas pueden definirse molecularmente, por lo que obtendríamos dos macroconstantes (una para el grupo ácido y otra para el grupo básico), o de forma submolecular y obtendríamos cuatro microconstantes. Las macroconstantes de disociación cuantifican la basicidad global de la molécula, pero no pueden asignar el protón a un lugar de unión determinado. Sin embargo, las microconstantes de disociación describen la capacidad de unión de un protón a un grupo funcional determinado, y son muy útiles para predecir las concentraciones de cada especie o isómero existente, a un pH determinado. Las moléculas con dos lugares de enlace de protones, como las fluoroquinolonas, tienen cuatro formas microscópicas de protonación, y dos de las microespecies son isómeros. El esquema de interconversión de las cuatro microespecies se esquematiza en la Fig. 3.
Figura 3. Esquema de interconversión de las cuatro microespecies de quinolona según el pH externo. Los estudios y revisiones realizados sobre el paso de las especies químicas de las quinolonas a través de la bicapa lipídica llegan a conclusiones contradictorias. Algunos autores afirman que sólo las formas no ionizadas son capaces de atravesar la membrana plasmática, que en principio es esencialmente impermeable a los iones cargados (21); de hecho, el triptófano, que puede ser considerado un análogo dipolar del indol, difunde cien veces menos que el indol a través de la membrana plasmática (22). Sin embargo, otros autores afirman que los iones híbridos o "zwitteriones" también pueden atravesar membranas biológicas, ya que su carga neta es nula (23); e incluso en moléculas de peso molecular elevado, la deslocalización de las cargas podría hacer que sustancias con suficiente lipofilia fueran capaces de difundir a través de membranas biológicas (24). Takács-Nováck (25) realizó un estudio en el cual cuantificó el porcentaje de cada microespecie presente a diferentes pH, y llegó a la conclusión de que la forma zwitteriónica siempre predomina sobre la neutra, aunque el valor del cociente zwitterión/neutra depende del tipo de fluoroquinolona. La forma dipolar es la predominante a pH fisiológico, y además a ese pH es cuando, en general, las fluoroquinolonas expresan su máxima actividad antimicrobiana. Así pues, a pesar de su carácter anfotérico, las quinolonas presentan a pH fisiológico una forma zwitteriónica que les permite difundir pasivamente a través de la membrana plasmática en mayor o menor grado. Quedaría también explicado por qué el pH extracelular es un factor fundamental a tener en cuenta en los estudios de incorporación al interior celular. Otro factor que influye en la acumulación de los antibióticos en el interior celular es la capacidad de unión a las proteínas. Esta unión se realiza mediante enlaces de naturaleza débil (enlaces electroquímicos), por lo que es reversible, pero adquiere la suficiente importancia para desplazar el equilibrio de antibiótico disuelto en el citosol y convertir a las proteínas en depósitos de antibiótico. Así mismo, el antibiótico unido a la proteína es inactivo. Cuando la concentración de antibiótico libre en el citosol disminuye, el gradiente de concentraciones se modifica, el equilibrio se desplaza y parte del antibiótico unido a la proteína se libera. Este hecho es muy interesante al considerar la posibilidad de que las células fagocíticas se conviertan en transportadores fisiológicos de los antibióticos desde el torrente circulatorio hasta el lugar de la infección (26). La energía de activación es otro de los parámetros fisicoquímicos que se ha incluido recientemente en los estudios de penetración de los antibióticos. La energía de activación de Gibbs (Ea) se define como la cantidad de energía necesaria para llevar todas las moléculas de un mol de sustancia a una temperatura determinada, al estado de transición, en la cima de la barrera de activación, es decir, la energía mínima necesaria para que se produzca una reacción. Aplicada a este caso, es la energía mínima necesaria para que un mol de moléculas de un antibiótico atraviese la membrana plasmática a una temperatura determinada. Viene expresada por la ecuación de Arrhenius:
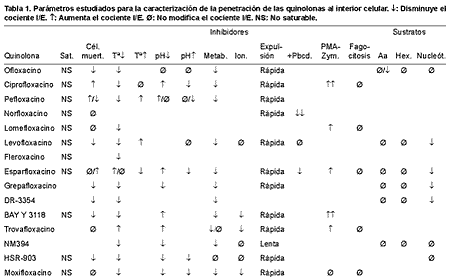
donde Ea es la energía de activación (en calorías por mol), T es la temperatura (en grados Kelvin), R es una constante (1,98 cal/mol-°K) y A es una constante propia de cada sustancia (27, 28). La energía de activación de los macrólidos, en su paso al interior de los neutrófilos, calculada por Laufen, Vazifeh y Mtairag, da como resultado 109 kJ/mol para la diritromicina, 114,2 kJ/mol para la josamicina, 75 kJ/mol para la roxitromicina, 61 kJ/mol para la eritromicina y 63 kJ/mol para RU 64004 (27-30). Varios autores sugieren que la entrada de algunos macrólidos parece ser un proceso de transporte activo, donde estaría implicado un transportador de nucleósidos. Sin embargo, la energía de activación para el paso de adenosina al interior del PMN es de 100,8 kJ/mol, por lo que Laufen (27) afirma que, en el caso concreto de la josamicina y la eritromicina, la diferencia en los valores de energía de activación se debe a que la josamicina sí utilizaría este transportador para atravesar la membrana del PMN, mientras que la eritromicina, que requiere una energía de activación menor que la necesaria para activar dicho transportador, atravesaría la membrana por un proceso de difusión pasiva. Este autor concluye que las diferencias de energía de activación entre los macrólidos con similar número de sitios de protonación, y ante una misma superficie de paso, se explicaría por la diferencia entre los mecanismos de transporte implicados en el proceso de paso. En cuanto a las quinolonas, sólo se conoce la energía de activación del levofloxacino (36 kJ/mol), por lo que esta quinolona parece no requerir gran cantidad de energía para atravesar la membrana plasmática, lo que posiblemente indica un paso mayoritariamente por difusión pasiva. MECANISMOS DE PENETRACIÓN DE LOS ANTIBIITICOS EN LOS PMN Los antibióticos pueden pasar al interior de la célula por diferentes mecanismos: fagocitosis, difusión pasiva a través de la membrana o de poros acuosos, y transporte activo. En la fagocitosis, el antibiótico es incluido en el interior del PMN cuando fagocita a las bacterias. Caracterización del paso por difusión pasiva El paso de la membrana plasmática por difusión pasiva es un mecanismo de transporte utilizado por antibióticos que a pH fisiológico se encuentran en forma electroquímica neutra y son lipófilos. Como ejemplo de ello están la rifampicina o el etambutol. En la determinación del mecanismo de difusión pasiva, las variables que se suelen estudiar son la viabilidad celular, la temperatura y la saturación del proceso de penetración. En la Tabla 1 se muestra el efecto de estas variables en la penetración de las quinolonas. En cuanto a la viabilidad celular no hay un comportamiento homogéneo, y dependiendo de la quinolona no afecta o disminuye. En todas ellas, el proceso de entrada no es saturable en los intervalos de concentraciones estudiadas (algunas de las concentraciones más altas estudiadas estaban en el límite de la solubilidad de la quinolona), lo que abogaría por una difusión simple a través de la membrana plasmática. La baja temperatura disminuye, en general (excepto para trovafloxacino), la penetración de las quinolonas, y puede atribuirse bien a un enlentecimiento de los procesos de paso por transporte activo, o a una disminución del paso por difusión pasiva, ya que a 4 °C la membrana plasmática pierde fluidez por enfriamiento y rigidez de los fosfolípidos que conforman la bicapa (31).
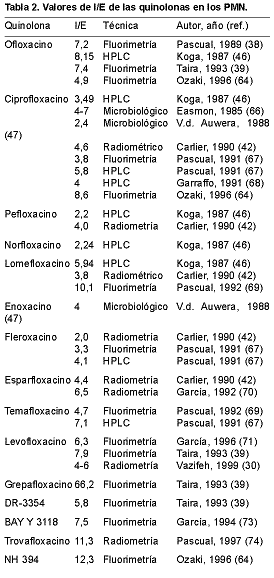
Abreviaciones: Sat.= saturación; Cel. muert. = células muertas; Tª¯ = 4 ºC; Tª(check) = >37 ºC; Metab. = metabólicos; Ion. = ionóforos; +Pbcd. = ensayo en presencia de probenecida; PMA-Zym. = estimuladores del PMN; Aa = aminoácidos; Hex. = hexosas; Nucleót. = adenosina y puromicina. Caracterización del paso por transporte activo En los estudios para determinar el mecanismo de transporte activo se utilizan diversos inhibidores metabólicos; unos son inhibidores de fuentes de energía (NaCN, FNa, 2,4 dinitrofenol, iodoacetamida, carbonil cianida m-clorofenilhidrazona [(CCCP)], otros son desacoplantes de potencial de membrana como la ouabaína, o ionóforos como el w-clorofenil hidrazona (CCP) y la gramicidina. En las quinolonas, los inhibidores energéticos, en general, afectan al paso de éstas al interior celular (Tabla 1), lo que sugiere que las quinolonas utilizan el transporte activo para pasar al interior de las células. Sin embargo, en una revisión realizada por Nikaido y Thanassi (21) sobre penetración de agentes liposolubles al interior de las bacterias, se llega a la conclusión de que los inhibidores estudiados para caracterizar el paso de las quinolonas al interior de la bacteria se habían empleado a concentraciones milimolares, muy elevadas para estos procesos, por lo que a esas concentraciones la disminución del cociente I/E encontrado podría deberse a mecanismos diferentes a la interferencia en los procesos energéticos. Por ejemplo, es conocida la capacidad de las fluoroquinolonas de quelarse con iones metálicos divalentes (32, 33). De hecho, el único inhibidor metabólico que es efectivo a concentraciones micromolares (CCCP) incrementa la penetración de las fluoroquinolonas en Escherichia coli (34). Por ello, en realidad no se puede concluir que las quinolonas necesiten, estrictamente, una fuente de energía para penetrar al interior celular. En este punto, conocer la energía de activación de los diferentes transportadores del PMN y la de las quinolonas podría ayudar a interpretar el transporte activo tal y como se ha razonado para la josamicina. Otros parámetros que se estudian para caracterizar la penetración de los antibióticos es la estimulación de las células empleando diferentes estimuladores: el forbol-miristato-acetato (PMA), estimulador de la proteincinasa C dependiente de fosfolípidos; el formil-metionil-leucil-fenilalanina (FMLP), estimulante de la producción de AMPc por una vía dependiente de Ca2+; o el zimosán, que aumenta la actividad del NADPH por la vía de la fosfolipasa A2. En las quinolonas, la estimulación de los PMN con zimosán o PMA aumenta significativamente su paso al interior celular. En el caso del ciprofloxacino, Loo y cols. (35) han demostrado recientemente que existe una relación estrecha entre el aumento de la incorporación de la quinolona al interior celular y la estimulación por PMA del sistema enzimático de una proteincinasa C dependiente de fosfolípidos. Pascual y cols. (36) también encuentran un aumento moderado (50%) en la penetración de ofloxacino y levofloxacino al interior del PMN previamente estimulado con PMA, aunque Vazifeh y cols. (30) no encuentran modificaciones en la incorporación del levofloxacino tras estimular los leucocitos con PMA o FMLP. Sin embargo, estimulando el fagocito mediante la fagocitosis previa de S. aureus no se modifica el cociente I/E. En los cetólidos también se ha observado la influencia de estos y otros sustratos, como el verapamilo, que modifica los mecanismos de transducción del leucocito, disminuyendo la acumulación de todos los derivados de la eritromicina A (37). Igualmente se ha estudiado la influencia de determinados sustratos simples (aminoácidos, nucleótidos, azúcares) en la penetración de las quinolonas, para observar posibles fenómenos de competencia en los transportadores de membrana. Los resultados son contradictorios, ya que hay autores que encuentran que el paso de ofloxacino disminuye en presencia de aminoácidos (38), mientras que otros no encuentran modificación alguna (39). Parece que los nucleótidos, y en concreto la puromicina y la adenosina, afectan al paso de la mayoría de las quinolonas estudiadas, lo que abogaría por un transportador común a todas ellas (Tabla 1). Es difícil, con todos estos datos, llegar a conclusiones claras sobre el mecanismo de transporte de las quinolonas a través de la membrana plasmática, pero parece ser que existiría más de un mecanismo implicado, aunque en las condiciones fisiológicas es la difusión pasiva la que permite el paso mayoritario de las quinolonas; sin embargo, no hay que descartar un transporte activo adicional, que se expresa más en determinadas condiciones experimentales. Otros parámetros que influyen en la acumulación de los antibióticos El estudio del proceso de salida o elución de los antibióticos desde el interior celular es importante por varias razones: En el caso de las quinolonas, la elución desde el interior de la célula es rápida, por lo que, cuando desaparece el gradiente de concentraciones, la concentración de antibiótico en el interior disminuye drásticamente. Esto disminuiría la posibilidad de convertir a los PMN y los monocitos en depósitos transportadores del antibiótico al lugar de la infección (26). En la caracterización de los procesos de elución se ha estudiado la influencia de la probenecida, un inhibidor de las bombas de eflujo de aniones. Los datos encontrados en la literatura muestran que la probenecida inhibe la elución del norfloxacino y el esparfloxacino (40, 41). Esto podría explicar, en parte, por qué algunas quinolonas se acumulan más en el interior de células muertas, donde las bombas de expulsión no actuarían, hecho que ocurre con ciprofloxacino, esparfloxacino o pefloxacino (aunque en estos dos últimos los datos aportados por diferentes autores se contradicen). Sin embargo, Vazifeh y cols. (30) afirman que la probenecida no inhibe la expulsión del levofloxacino desde el interior de los PMN humanos (30). Localización intracelular de los antibióticos en los PMN A medida que las técnicas analíticas avanzan, se va profundizando y especializando en el estudio de la localización de los antibióticos en el interior celular, y el interés por el conocimiento de la localización subcelular del antibiótico parte de que los microorganismos intracelulares se localizan en diferentes orgánulos (lisosoma, fagosoma, fagolisosoma o citosol), tal y como se ha comentado en la introducción de esta revisión; si el antibiótico no está localizado en la misma estructura celular que la bacteria, no entrará en contacto con ella, y no será activo. Así mismo, conocer la localización intracelular del antibiótico ayuda a explicar fenómenos como la acumulación (los macrólidos y la clindamicina se concentran en el interior de los lisosomas por gradiente de pH), o la pobre correlación que hay entre acumulación y actividad antibacteriana con la eritromicina o la clindamicina (el pH ácido de los lisosomas inactiva la molécula del antibiótico). En los estudios realizados sobre localización subcelular de las quinolonas, varios autores coinciden en que éstas permanecen libres en el citosol, sin unirse a una estructura específica, pero otros afirman que el esparfloxacino se concentra un 30% en el interior de los gránulos azurófilos, y que el norfloxacino y el temafloxacino se acumulan un 30% en estos gránulos y de ahí pasan a los lisosomas (30, 40-43). PENETRACIÓN DE LOS DIFERENTES GRUPOS ANTIBITICOS EN EL INTERIOR DE LOS PMN Numerosos estudios han mostrado que los betalactámicos, tanto las penicilinas como las cefalosporinas, apenas se acumulan en el interior de los fagocitos, aunque ello no quiere decir que sean incapaces de atravesar la membrana plasmática (muchos compuestos tienen lipofilia suficiente para difundir a través de la bicapa lipídica), sino que son incapaces de quedar retenidos en el interior celular (16, 18, 31, 44-47). De hecho, todos los betalactámicos poseen en su estructura fundamental un grupo carboxílico libre, y por tanto se pueden considerar ácidos orgánicos. El pKa de este grupo se encuentra entre 3 y 5, por lo que cabe esperar que estas moléculas penetren pero sean excluidas del interior celular, al ser éste más ácido que el medio extracelular (48). Es decir, los betalactámicos son capaces de penetrar en el interior de la célula, pero no son retenidos por ella, debido a su pKa. De hecho, un derivado básico de la bencilpenicilina, denominado dimetilaminopropil-bencilpenicilamida, cuyo grupo carboxílico está enmascarado por un radical básico, se acumula en el interior celular a una concentración de cuatro a cinco veces la extracelular (20), y algunos ésteres de la ampicilina, diseñados como profármacos (pivampicilina, ptalimidometilampicilina y S-acetil-2-tioetil-ampicilina), también son capaces de penetrar y acumularse en el interior de los PMN (49). Aunque muchos autores han afirmado que los aminoglucósidos no penetran en la célula, estudios en fibroblastos y macrófagos han mostrado que cuando estas células se incuban durante varios días con aminoglucósidos, éstos se acumulan, lentamente pero de forma estable, con valores de concentración intracelular/extracelular (I/E) de 2 a 4. La localización intracelular, aunque no homogénea, es mayoritariamente en los lisosomas, por lo que parece que la penetración de estos antibióticos se produce por pinocitosis. Como los PMN tienen una vida media muy corta, y además no poseen la capacidad de incluir sustancias por pinocitosis, es improbable que los aminoglucósidos se acumulen en su interior (17, 50-52). Hand y King-Thompson (53) encontraron que aunque la acumulación de gentamicina en el interior de los PMN era escasa, este aminoglucósido era capaz de disminuir el número de S. aureus fagocitados. Las lincosaminas, como la clindamicina, presentan una gran capacidad de penetrar y acumularse en el interior de varios tipos de células. En los PMN el cociente I/E alcanza valores de 40. El mecanismo de paso a través de la membrana plasmática es rápido, dependiente de energía, aumenta con la fagocitosis y parece mediado por transportadores de nucleótidos; se localiza intracelularmente en el citosol y los lisosomas (31, 44, 46, 54-57). Sin embargo no hay correlación entre la buena penetración y la subsiguiente actividad de la clindamicina frente a S. aureus fagocitado (53). Se ha propuesto que podría deberse a que la clindamicina inactiva los sistemas bactericidas de producción de superóxido y peróxido de hidrógeno en el PMN, o a que el antibiótico se inactiva por el pH del citosol o el lisosoma, donde se localiza (26, 58). La mayoría de los macrólidos presentan la capacidad de penetrar y acumularse en el interior de diferentes tipos de células. En los PMN los valores de los cocientes I/E oscilan entre 20 para la claritromicina, 30 para la eritromicina y la roxitromicina, 20 a 300 para la azitromicina, y 200 a 400 para RU-64004. La penetración es rápida, parece ser dependiente de energía y mediada por transportadores de nucleósidos (18, 28, 29, 31, 44, 45, 47, 59-61). Intracelularmente parecen asociados a los lisosomas en los macrófagos y a los gránulos azurófilos en los PMN (62). La actividad intracelular de la mayoría de los macrólidos es escasa (53). En la roxitromicina esta carencia parece estar asociada a la capacidad de este antibiótico de inhibir la producción de superóxido y peróxido de hidrógeno por parte del PMN (28). En otros macrólidos parece asociarse a una desactivación debida al pH ácido del fagolisosoma donde se localizan (58, 63). Sin embargo, los nuevos macrólidos como la azitromicina sí presentan actividad intracelular in vivo frente a S. aureus (61). En la Tabla 2 se resume el valor del cociente I/E de las quinolonas en los PMN, indicando también el método empleado para determinar su valor y el autor que lo hizo. Puede observarse que hay tres grupos de quinolonas: uno al cual pertenecen las primeras fluoroquinolonas, cuyos valores de cociente I/E oscilan entre 2 y 8; otro grupo compuesto por aquellas quinolonas cuya concentración intracelular oscila entre 10 y 30 veces la concentración extracelular; y un tercer grupo, al que pertenece el grepafloxacino, con un I/E mayor de 30.
TÉCNICAS PARA DETERMINAR LA PENETRACIÓN DE LOS ANTIBIITICOS EN EL INTERIOR CELULAR En los estudios de penetración intracelular se han utilizado diferentes métodos experimentales. Los primeros estudios usaron técnicas indirectas para valorar la penetración: si la reducción del número de microorganismos viables en el interior de las células era mayor en presencia de antibiótico que en su ausencia, deducían la penetración del antimicrobiano (76, 77). Este método es poco sensible, ya que la supervivencia de las bacterias no se correlaciona necesariamente con que el antibiótico no haya penetrado; puede ocurrir que el antibiótico esté inactivado por el entorno intracelular, puede ser bacteriostático o bien puede que esté localizado en un orgánulo diferente a las bacterias. También la interpretación se complica por las posibles interacciones del antibiótico y el sistema bactericida celular, o puede que la muerte bacteriana sea independiente de la actividad antibiótica (47, 77). Con posterioridad se han ido introduciendo técnicas capaces de cuantificar la cantidad de antibiótico que pasa al interior de las células, mediante métodos microbiológicos, marcado radiactivo del antimicrobiano, fluorimetría o cromatografía líquida de alta densidad (HPLC). La cuantificación del antimicrobiano intracelular presenta los mismos inconvenientes con todos los métodos utilizados, ya que miden la cantidad total de antimicrobiano asociado a la célula, tanto a la fracción lipídica como a la proteica, sin diferenciar el antibiótico intracelular del unido a la superficie externa de la célula (78). La duración de los procesos de lavado y centrifugado de las células, realizados para eliminar el antibiótico extracelular, tiene importancia en aquellos antimicrobianos que penetran mediante un proceso de difusión, ya que parte del antibiótico intracelular puede salir al exterior (18, 79). El ensayo microbiológico mide el halo de inhibición producido por la suspensión de los PMN, una vez éstos han sido incubados con el antibiótico durante cierto tiempo, separados del líquido extracelular por centrifugación y lavado, y lisados de las células para que liberen el antibiótico de su interior (58). La técnica cromatográfica (HPLC) es muy específica, pero requiere grandes volúmenes de células y altas concentraciones de antibiótico, por lo que pocas veces simula las concentraciones fisiológicas alcanzadas en el plasma (46). La técnica radiométrica es muy sensible y reproducible, pero requiere que los compuestos estén marcados radiactivamente, y es frecuente que en esta forma sufran descomposición radiolítica durante su almacenamiento, por lo que pueden dar falsos resultados. De hecho, Anderson y cols. (63) han sugerido que las altas concentraciones intracelulares aparentes de algunos antibióticos (medidos por técnicas radiométricas) no se correlacionan con la potencial bioactividad intracelular. La técnica fluorimétrica es sensible y reproducible, basada en la fluorescencia natural del núcleo de determinados compuestos, pero queda limitada a aquellos que tengan esta propiedad (algunas quinolonas, quinina y sus derivados, etc.) (38, 80). Otro inconveniente que presentan las técnicas de HPLC, radiométrica y fluorimétrica, es que cuantifican el antibiótico como especie química, mientras que el método microbiológico mide su actividad antimicrobiana. INFLUENCIA DE OTROS F«RMACOS EN LA PENETRACIÓN DE LOS ANTIBIITICOS En la práctica clínica hospitalaria es habitual el tratamiento conjunto con varios fármacos. En el caso de los pacientes inmunodeprimidos, sea cual sea el origen de la inmunodepresión, es habitual el tratamiento conjunto con un antibiótico, un antifúngico, un antiviral, un glucocorticoide o un antipirético. Es interesante conocer si la presencia de alguno de estos fármacos junto con antibióticos capaces de penetrar en el interior celular modifica el paso de éstos al interior de la célula. Hasta la actualidad existen pocos trabajos que estudien esta influencia, y todos determinan sólo un tiempo de incubación. Unas veces estudian la influencia de la presencia de un determinado fármaco en la penetración intracelular, con los PMN estimulados y sin estimular, y otras veces tratan previamente las células con el fármaco antes de añadir el antibiótico. Sobre los macrólidos y la clindamicina, se ha estudiado la influencia de la pentoxifilina y dos de sus derivados en la penetración de la roxitromicina, la diritromicina y la clindamicina al interior de los PMN, llegando a la conclusión de que la presencia de estos fármacos incrementa la penetración de los antibióticos estudiados, tanto en células en reposo como durante la fagocitosis (81). Los estudios realizados con quinolonas también son escasos. Así, se ha observado que la presencia de antibióticos (cloxacilina, vancomicina, teicoplanina, daptomicina, rifampicina, clindamicina, imipenem, metronidazol y amikacina) no modifica la penetración de ofloxacino, levofloxacino, ciprofloxacino y esparfloxacino al interior de la célula. Sin embargo, si los neutrófilos se estimulan con zimosán, la presencia de metronidazol disminuye significativamente el paso del esparfloxacino al interior celular (67, 70, 82). Los antifúngicos estudiados, amfotericina B y fluconazol, no parecen afectar a la penetración de ofloxacino y levofloxacino al interior celular, pero la presencia de amfotericina B disminuye significativamente el cociente I/E del ciprofloxacino en células sin estimular y el del esparfloxacino en células estimuladas con zimosán (67, 82). Otro grupo de fármacos estudiados son los antineoplásicos metotrexato, doxorubicina, cisplatino y paclitaxel. Los tres primeros no modifican la penetración del esparfloxacino, pero altas concentraciones de paclitaxel disminuyen significativamente la penetración del ofloxacino y del levofloxacino al interior celular (71, 82). La presencia de antiinflamatorios (betametasona, hidrocortisona y fenilbutazona) no modifica significativamente la penetración del ofloxacino y el grepafloxacino al interior de los PMN humanos, aunque la presencia simultánea de ácido acetilsalicílico disminuye significativamente la acumulación de estas quinolonas a los 30 minutos de incubación (65, 72). También se ha estudiado que la presencia de los antivirales aciclovir, ganciclovir y foscarnet no modifica significativamente la penetración de ofloxacino al interior celular, aunque parece que retrasan el tiempo en que se alcanza el máximo cociente I/E (65). CONCLUSIONES La penetración de los antimicrobianos al interior de los leucocitos se presenta como un hecho de interés desde numerosos puntos de vista: diseño de nuevos fármacos, interacción de los antibióticos con el sistema inmunitario, el PMN como transportador de antibióticos hasta el lugar de la infección, etc. Es necesario estandarizar un método que pueda hacer comparables los datos experimentales obtenidos, así como realizar estudios de actividad intrafagocítica de los antibióticos, ya que no es garantía su paso al interior celular para su posterior actividad frente a los microorganismos fagocitados. También es importante diferenciar penetración de acumulación, así como presencia intracelular y localización intracelular. Las quinolonas, los macrólidos, la rifampicina y la clindamicina, así como el nuevo grupo de los cetólidos, presentan una buena capacidad de acumulación, son activos frente a los microorganismos comúnmente intracelulares y representan una buena alternativa en el caso de infecciones recidivantes, como ocurre por ejemplo con ciprofloxacino en el estado de portador en la salmonelosis. Queda un largo camino por recorrer en el campo del estudio de la interacción de los medicamentos y el cuerpo humano, y a medida que las técnicas analíticas son cada vez más sensibles y reproducibles, se nos permite acceder a niveles subcelulares, antes inexplorados. En este sentido, el estudio de la penetración de los antibióticos en el interior de los PMN, su localización y relación con las cascadas metabólicas, y los procesos de transducción de la célula, son una línea de investigación muy nueva, con gran capacidad de desarrollo, ya que poder diseñar antibióticos capaces de acumularse sin llegar a producir toxicidad y permanecer en el interior del PMN hasta el lugar de la infección es la forma más natural de conseguir erradicar la infección evitando cualquier efecto secundario. BIBLIOGRAFÍA 1. Trouet, A.L., Tulkens, P. Intracellular penetration and distribution of antibiotics: The basis for an improved chemotherapy of intracellular infections. En: Ninet, L., Bost, P.E., Bouanchaud, D.H., Florent, J. (Eds.). The future of antibiotherapy and antibiotic research. Academic Press, London 1981; 336-349. 2. Neerman, R., Keller, N., Barziali, A., Korenman, Z., Sela, S. Prevalence of internalisation-associated gene, prtF1, among persisting group-A Streptococcus strains isolated from asymptomatic carriers. Lancet 1998; 352: 1974-1977. 3. Okada, N., Tatsuno, I., Hanski, E., Caparon, M., Sasakawa, C. Streptococcus pyogenes protein F promotes invasion of HeLa cells. Microbiology 1998; 144: 3079-3086. 4. Mandell, G.L. Catalase, superoxide dismutase, and virulence of Staphylococcus aureus. In vitro and in vivo studies with emphasis on staphylococcal-leukocyte interaction. J Clin Invest 1975; 55: 561-566. 5. Moulder, J.W. Comparative biology of intracellular parasitism. Microbiol Rev 1985; 49: 298-337. 6. Van der Auwera, P. Interactions between antibiotics and phagocytosis in bacterial killing. Scand J Infect Dis 1991; 74 (Suppl.): S42-S48. 7. Reinoso, R.F., Lanao, J.M., Lorente, F., López, F.G., Domínguez-Gil, A. Uptake of antibiotics by phagocytic cells: Study methods and therapeutic implications. Rev Esp Quimioterap 1995; 8: 100-108. 8. Braga, P.C., Sala, MT, Mancini, L., Da Sasso, M. Phagocytosis and intracellular killing of rokitamycin-exposed staphylococci by human polymorphonuclear leukocytes. Chemother 1998; 44: 42-49. 9. Labro, M.T. Interference of antibacterial agents with phagocyte functions: Immunomodulation or "immuno-fairy tales"? Clin Microbiol Rev 2000; 13: 615-650. 10. Niwa, M., Hotta, K., Kanamori, Y., Matsuno, H. Differential uptake of grepafloxacin by human circulating blood neutrophils and those exudated into tissues. Eur J Pharmacol 2001; 428: 121-126. 11. Mandell, G.L., Coleman, E. Uptake, transport and delivery of antimicrobial agents by human polymorphonuclear neutrophils. Antimicrob Agents Chemother 2001; 45: 1794-1798. 12. Magoffin, R.L., Spink, W.W. The protection of intracellular Brucella against streptomycin alone and in combination with other antibiotics. J Lab Clin Med 1951; 37: 924-929. 13. Shaffer, J.M., Kucera, C.J., Spink, W.W. The protection of intracellular Brucella against therapeutic agents and the bactericidal action of serum. J Exp Med 1953; 97: 77-81. 14. Holmes, B., Quie, P.G., Windhorst, D.B., Pollara, B., Good, R.A. Protection of phagocytized bacteria from the killing action of antibiotics. Nature (Lond) 1966; 210: 1131. 15. Solberg, C.O. Protection of phagocytized bacteria against antibiotics. A new method for the evaluation of neutrophil granulocyte functions. Acta Med Scand 1972; 191: 383-389. 16. Mandell, G.L. Interaction of intraleukocytic bacteria and antibiotics. J Clin Invest 1973; 52: 1673-1679. 17. Tulkens, P.M. Intracellular distribution and activity of antibiotics. Eur J Clin Microbiol Infect Dis 1991; 10: 100-107. 18. Brown, K.N., Percival, A. Penetration of antimicrobials into tissue culture cells and leucocytes. Scand J Infect Dis 1978; 14 (Suppl.): S251-S260. 19. Molski, T.F.P., Naccache, P.H., Volpi, M., Wolpert, L.M., Sha'afi, R.I. Specific modulation of the intracellular pH of rabbit neutrophils by chemotactic factors. Biochem Biophys Res Commun 1980; 94: 508-514. 20. Renard, C., Vanderhaeghe, H.J., Claes, P.J., Zenebergh, A., Tulkens, P.M. Influence of conversion of penicillin G into a basic derivative on its accumulation and subcellular localization in cultured macrophages. Antimicrob Agents Chemother 1987; 31: 410-416. 21. Nikaido, H., Thanassi, D.G. Penetration of lipophilic agents with multiple protonation sites into bacterial cells: Tetracyclines and fluoroquinolones as examples. Antimicrob Agents Chemother 1993; 37: 1393-1399. 22. Bean, R.C., Shepherd, W.C., Chan, H. Permeability of lipid bilayer membranes to organic solutes. J Gen Physiol 1968; 52: 495-508. 23. Furet, Y.X. Deshusses, J., Pechère, J.C. Transport of pefloxacin across the bacterial cytoplasmic membrane in quinolone-susceptible Staphylococcus aureus. Antimicrob Agents Chemother 1992; 36: 2506-2511. 24. Reymond, F., Carrupt, P.A., Testa, B., Girault, H.H. Charge and delocalisation effects on the lipophilicity of protonable drugs. Chem Eur J 1999; 5: 39-47. 25. Takács-Nováck, K., Béla, N., Hermecz, I., Kerexztúri, G., Podányi, B. Szasz, G. Protonation equilibria of quinolone antibacterials. J Pharma Sci 1990; 79: 1023-1028. 26. Hand, W.L. Antibiotics and phagocytic cells. Antimicrob Newletter 1988; 5: 53-60. 27. Laufen, H., Wildfeuer, A. Ketics of the uptake of antimicrobials agents by human polymorphonuclear leucocytes. Arzneim Forsch 1989; 39: 233-235. 28. Mtairag, E.M., Abdelghaffar, H., Douhet, C., Labro, M.T. Role of extracellular calcium in in vitro uptake and intraphagocytic location of macrolides. Antimicrob Agents Chemother 1995; 39: 1676-1682. 29. Vazifeh, D., Abdelghaffar, H., Labro, M.T. Cellular accumulation of the new ketolide RU 64004 by human neutrophils: Comparison with that of azithromycin and roxithromycin. Antimicrob Agents Chemother 1997; 41: 2099-2107. 30. Vazifeh, D., Bryskier, A., Labro, M.T. Mechanism underlying levofloxacin uptake by human polymorphonuclear neutrophils. Antimicrob Agents Chemother 1999; 43: 246-252. 31. Johnson, J D., Hand, W. L., Francis, J.B., King-Thompson, N., Corwin, R.W. Antibiotic uptake by alveolar macrophages. J Lab Clin Med 1980; 35: 429-439. 32. Chapman, J.S., Georgopapadakou, N.H. Routes of quinolone permeation in Escherichia coli. Antimicrob Agents Chemother 1988; 32: 438-442. 33. Timmers, K., Sternglanz, R. Ionization and divalent cation dissociation constants of nalidixic and oxolinic acids. Bioinorg Chem 1978; 9: 145-155. 34. Diver, J.M., Piddock, L.J.V., Wise, R. The accumulation of five quinolone antibacterial agents by Escherichia coli. J Antimicrob Chemother 1990; 25: 319-333. 35. Loo, K.C., Cario, A.C., Zhang, F., Walters, J.D. Regulation of ciprofloxacin uptake in human promyelocytic leukemia cells and polymorphonuclear leukocytes. J Leukocyte Biol 1997; 61: 619-623. 36. Pascual, A., García, I., Perea, E.J. Uptake and intracellular activity of an optically active ofloxacin isomer in human neutrophils and tissue culture cells. Antimicrob Agents Chemother 1990; 34: 277-280. 37. Abdelghaffar, H., Vazifeh, D., Labro, M.T. Cellular uptake of two fluoroketolides, HMR 3562 and HMR 3787, by human polymorphonuclear neutrophils in vitro. Antimicrob Agents Chemother 2001; 45: 2798-2806. 38. Pascual, A., García, I., Perea, E.J. Fluorometric measurement of ofloxacin uptake by human polymorphonuclear leukocytes. Antimicrob Agents Chemother 1989; 33: 653-656. 39. Taira, K., Koga, H., Kohno, S. Accumulation of a newly developed fluoroquinolone, OPC-17116, by human polymorphonuclear leukocytes. Antimicrob Agents Chemother 1993; 37: 1877-1881. 40. Carlier, M.B., Scorneaux, B., Zenebergh, A., Desnottes, J.F., Tulkens, P.M. Cellular uptake, localization and activity of fluoroquinolones in uninfected and infected macrophages. J Antimicrob Chemother 1990; 26 (Suppl. B): S27-S39. 41. Cao, C.X., Silverstein, S.C., Neu, H.C., Steinberg, T.H. J774 macrophages secrete antibiotics via organic anion transporters. J Infect Dis 1992; 165: 322-328. 42. Carlier, M.B., Scorneaux, B., Tulkens, P.M. Uptake and subcellular localization of sparfloxacin (AT-4140, RP-64206;S) in phagocytic cells. 30th Interscience Conference of Antimicrobial Agents and Chemotherapy, Atlanta 1990; Abstr. 1243. 43. Takahashi, Y., Fuji, A., Sakamoto, K., Okezako, E., Nagata, O., Kato, H. Uptake and intracellular activity of HSR-903, a new quinolone, in human polymorphonuclear leukocytes. 38th Interscience Conference of Antimicrobial Agents and Chemotherapy, San Diego, California 1998; Abstr. F-082. 44. Prokesch, R.C., Hand, W.L. Antibiotic entry into human polymorphonuclear leukocytes. Antimicrob Agents Chemother 1982; 21: 373-380. 45. Hand, W.L., Boozer, R.M., King-Thompson, N.L. Antibiotic uptake by alveolar macrophages of smokers. Antimicrob Agents Chemother 1985; 27: 42-45. 46. Koga, H. High-performance liquid chromatography measurement of antimicrobial concentrations in polymorphonuclear leukocytes. Antimicrob Agents Chemother 1987; 31: 1904-1908. 47. Van der Auwera, P., Matsumoto, T., Husson, M. Intraphagocytic penetration of antibiotics. J Antimicrob Chemother 1988; 22: 185-192. 48. Waddell, W.J., Bates, R.G. Intracellular pH. Physiol Rev 1969; 49: 285-329. 49. Paternotte, I., Burton, S., Sonveaux, E., Tulkens, P.M. Uptake of esters prodrugs of ampicillin (pivampicillin, phthalimidonethylampicillin, S-acetyl-2-thioethyl-ampicillin) in macrophages and PMN with intracellular liberation of ampicillin. 38th Interscience Conference of Antimicrobial Agents and Chemotherapy, San Diego, California 1998; Abstr. F-7. 50. Bonventre, P.F., Imhoff, J.G. Uptake of 3H-dihydrostreptomycin by macrophages in culture. Infect Immun 1970; 2: 86-93. 51. Tulkens, P.M., Trohet, A. The uptake and intracellular accumulation of aminoglycosides antibiotics in lysosomes of cultured fibroblasts. Biochem Pharmacol 1978; 27: 415-424. 52. Van den Broek, P.J. Antimicrobial drugs, microorganisms and phagocytes. Rev Infect Dis 1989; 11: 213-245. 53. Hand, W.L., King-Thompson, N.L. Contrast between phagocyte antibiotic uptake and subsequent intracellular bactericidal activity. Antimicrob Agents Chemother 1986; 29: 135-140. 54. Klempner, M.S., Styrt, B. Clindamycin uptake by human neutrophils. J Infect Dis 1981; 144: 472-475. 55. Hand, W.L., King-Thompson, N.L. Membrane transport of clindamycin in alveolar macrophages. Antimicrob Agents Chemother 1982; 21: 241-247. 56. Steinberg, T.H., Hand, W.L. Effects of phagocytosis on antibiotic and nucleoside uptake by human polymorphonuclear leukocytes. J Infect Dis 1984; 149: 397-403. 57. Hand, W.L., King-Thompson, N.L. Uptake of antibiotics by human polymorphonuclear leukocyte cytoplasts. Antimicrob Agents Chemother 1990; 34: 1189-1193. 58. Pemán, J., Cantón, E., Ramón, M.S., Jiménez, T., Gobernado, M. Penetración y actividad de los antimicrobianos en el interior de los fagocitos. Rev Esp Quimioterap 1991; 4: 27-36. 59. Martin, J.R., Johnson, P., Miller, M.F. Uptake, accumulation and egress of erythromycin by tissue culture cells of human origin. Antimicrob Agents Chemother 1985; 27: 314-319. 60. Ishiguro, M., Koga, H., Kohno, S., Hayashi, T., Yamaguchi, K., Hirota, M. Penetration of macrolides into human polymorphonuclear leucocytes. J Antimicrob Chemother 1989; 24: 719-729. 61. Wildfeuer, A., Laufen, H., Zimmermann, T. Uptake of azithromycin by various cells and its intracellular activity under in vivo conditions. Antimicrob Agents Chemother 1996; 40: 75-79. 62. Carlier, M.B., Zenebergh, A., Tulkens, P.M. Cellular uptake and subcellular distribution of roxithromycin and erythromycin in phagocytic cells. J Antimicrob Chemother 1987; 20 (Suppl. B): S47-S56. 63. Anderson, R., Joone, G., Van Rensburg, C.E.J. An in-vitro investigation of the intracellular bioactivity of amoxicillin, clindamycin and erythromycin for Staphylococcus aureus. J Infect Dis 1986; 153: 593-600. 64. Ozaki, M., Komori, K., Matsuda, M. y cols. Uptake and intracellular activity of NM394, a new quinolone, in human polymorphonuclear leukocytes. Antimicrob Agents Chemother 1996; 40: 739-742. 65. Orero, A., Cantón, E., Bermejo, M.V. y cols. Influencia de los antiinflamatorios en la acumulación de ofloxacino en el interior de los leucocitos polimorfonucleares humanos. Rev Esp Quimioterap 1999; 12: 144-148. 66. Easmon, C.S.F., Crane, J.P. Uptake of ciprofloxacin by human neutrophils. J Antimicrob Chemother 1985; 16: 67-73. 67. Pascual, A., García, I., Conejo, M.C., Perea, E.J. Fluorometric and High-Performance Liquid Chromatographic measurement of quinolone uptake by human neutrophils. Eur J Clin Microbiol Infect Dis 1991; 10: 969-971. 68. Garraffo, R., Jambou, D., Chichimanian, R.M., Ravoire, S., Lapalus, P. In vitro and in vivo ciprofloxacin pharmacokinetics in human neutrophils. Antimicrob Agents Chemother 1991; 35: 2215-2218. 69. Pascual, A., García, I., Perea, E.J. Entry of lomefloxacin and temafloxacin into human neutrophils, peritoneal macrophages, and tissue culture cells. Diagn Microbiol Infect Dis 1992; 15: 393-398. 70. García, I., Pascual, A., Perea, E.J. Effects of several antimicrobial agents on ciprofloxacin uptake by human neutrophils. Eur J Clin Microbiol Infect Dis 1992; 11: 260-262. 71. García, I., Pascual, A., Salvador, J., Conejo, M.C., Perea, E.J. Effect of paclitaxel alone or in combination on the intracellular penetration and activity of quinolones in human neutrophils. J Antimicrob Chemother 1996; 38: 859-863. 72. Orero, A., Cantón, E., Velert, M.M., Gobernado, M. Uptake of grepafloxacin into polymorphonuclear leukocytes: Influence of anti-inflammatory drugs. 38th Interscience Conference of Antimicrobial Agents and Chemotherapy, San Diego, California 1998; Abstr. 115. 73. García, I., Pascual, A., Perea, E.J. Intracellular penetration and activity of BAY Y 3118 in human polymorphonuclear leukocytes. Antimicrob Agents Chemother 1994; 38: 2426-2429. 74. Pascual, A., García, I., Ballesta, S., Perea, E.J. Uptake and intracellular activity of trovafloxacin in human phagocytes and tissue-cultured epithelial cells. Antimicrob Agents Chemther 1997; 41: 274-277. 75. Pascual, A., García, I., Ballesta, S., Perea, E.J. Uptake and intracellular activity of moxifloxacin in human neutrophils and tissue-cultured epithelial cells. Antimicrob Agents Chemother 1999; 43: 12-15. 76. Klempner, M.S. Antibiotic penetration into phagocytes. A determinant of therapeutic efficacy? Drug Ther 1982; 12: 44-53. 77. Peterson, L.R., VanEtta, L.L., Fasching, C.E., Gerding, D.N. Effect of protein binding on stimulated intravascular and extravascular kinetics of cefotaxime in an in vitro model. Antimicrob Agents Chemother 1984; 25: 58-61. 78. Labro, M.T., Babin-Chevaye, C., Hakim, J. Influence of subinhibitory concentrations of ceftriaxone on opsonization and killing of Pseudomonas aeruginosa by human neutrophils. J Antimicrob Chemother 1988; 22: 341-352. 79. Klempner, M.S. White cells. En: Ristuccia, A.M., Cunha, B.A. (Eds.). Antimicrobial therapy. Raven Press, New York 1984; 513-517. 80. El Benna, J., Pasquier, C., Labro, M.T. Quinine uptake by human polymorphonuclear neutrophils. Antimicrob Agents Chemother 1991; 35: 1474-1478. 81. Hand, W.L., Hand, D.L. Influence of pentoxifilline and its derivatives on antibiotic uptake and superoxide generation by human phagocytic cells. Antimicrob Agents Chemother 1995; 39: 1574-1579. 82. Pascual, A., García, I., Conejo, M.C., Perea, E.J. Effects of antimicrobial and antineoplastic drugs on the uptake of sparfloxacin by human neutrophils. J Antimicrob Agents 1994; 34: 171-174.
|