Tratamiento oral hospitalario de las infecciones de la piel y los tejidos blandos
J. Barberán
Servicio de Enfermedades Infecciosas, Hospital Gómez Ulla, Madrid
|
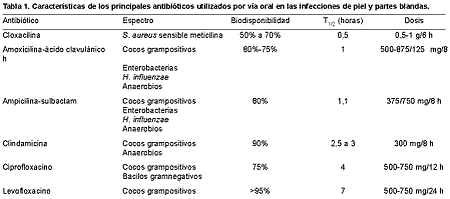
Las infecciones de la piel y los tejidos blandos tienen una gran prevalencia en nuestro medio, pero a la vez no son las que mejor se conocen por los numerosos cuadros clínicos que incluyen y la confusión terminológica existente. La mayoría son leves o moderadas y pueden ser tratadas de forma ambulatoria, aunque algunas tienen una gravedad extrema y ponen en peligro la vida del paciente (1-3). La piel del hombre está dotada de una serie de mecanismos defensivos (impermeabilidad del estrato córneo, recambio celular superficial, pH ácido e inmunidad celular formada por IgA, células del sistema mononuclear-fagocítico y el factor epidérmico activante de los linfocitos T) que la hacen ser una barrera protectora frente a la infección. Sin embargo, su estrato córneo y sobre todo los folículos pilosos y los conductos sebáceos, están colonizados por una gran variedad de bacterias y hongos, que aprovechan cualquier alteración de los mecanismos protectores o solución de continuidad para alcanzar la epidermis, la dermis o las partes blandas subyacentes y desarrollar una infección. En su aparición influyen la virulencia del microorganismo, el tamaño del inóculo, la sinergia bacteriana (aerobios y anaerobios) y determinadas situaciones del huésped: reducción del flujo arterial, estasis venosa o linfática, fenómenos inflamatorios locales, presencia de cuerpos extraños, diabetes mellitus, inmunodepresión, alcoholismo, malnutrición, etc. (4). La etiología es muy variada, con participación de bacterias, hongos y parásitos, que ocasionan un gran número de cuadros clínicos, cada uno de los cuales puede estar causado por diferentes microorganismos, siendo muchos polimicrobianos. Las bacterias que con mayor frecuencia participan son Staphylococcus aureus, Streptococcus pyogenes, enterobacterias, Pseudomonas aeruginosa y anaerobios (Bacteroides del grupo fragilis y Clostridium spp.). Hay otras que se asocian a situaciones especiales, como Pasteurella multocida y Eikenella corrodens con mordeduras, Vibrio vulnificus y Mycobacterium marinum con heridas en medio acuático salado, y Aeromonas y Plesiomonas en agua dulce. PIODERMAS Bajo esta denominación se incluye un amplio grupo de cuadros clínicos cutáneos de importancia leve a moderada. ImpétigoEs una infección superficial de la piel que afecta con mayor frecuencia a la población infantil, caracterizada por la aparición de lesiones vesiculosas, a veces rodeadas de un pequeño halo inflamatorio, que después se rompen y forman unas costras de aspecto acaramelado. Suelen acompañarse de adenopatías y ser pruriginosas, lo que facilita su diseminación mediante la autoinoculación por rascado. Habitualmente se localizan en la cara, los brazos y la parte distal de las piernas. S. pyogenes es el principal agente causal, pero S. aureus se aísla cada vez con más frecuencia, si bien este hecho se considera como una invasión secundaria; además, existen cepas productoras de bacteriocinas que dificultan el aislamiento de los estreptococos (5). Bacillus cereus puede ser el cuasante en pacientes inmunodeprimidos. Foliculitis Consiste en la formación de pequeñas pápulas o pústulas centradas en un folículo piloso y rodeadas por un eritema. Normalmente está causada por S. aureus, pero también puede deberse a P. aeruginosa, enterobacterias, Malassezia furfur y Candida. Forúnculo Es un nódulo profundo y doloroso de color rojizo constituido por un esfacelo o clavo, que a menudo se desarrolla a partir de una foliculitis. Se localiza fundamentalmente en zonas con abundantes folículos pilosos, fricción repetida y gran perspiración, como la cara, el cuello, las axilas y los glúteos, y su aparición se ve favorecida por la obesidad, la edad avanzada, la corticoterapia, las alteraciones de los fagocitos y la diabetes mellitus. S. aureus es el microorganismo productor. La coalescencia de varios forúnculos contiguos ocasiona una tumefacción extensa y profunda, con abundantes orificios por los que se drena la supuración, denominada ántrax. Celulitis Es una infección localizada en la dermis que se manifiesta por una extensa lesión eritematosa, edematizada, de bordes poco precisos, caliente y dolorosa, que se acompaña de una adenopatía regional satélite, fiebre y malestar general. La bacteriemia aparece en el 10% de las ocasiones y la complicación con tromboflebitis es fácil, sobre todo en ancianos, si la infección se localiza en una extremidad inferior. Los traumatismos, a veces mínimos, y la existencia previa de úlceras o forúnculos favorecen el desarrollo de celulitis. Los agentes que con más frecuencia producen esta infección son S. pyogenes y S. aureus. Erisipela Es una infección típicamente estreptocócica, sobre todo por S. pyogenes, más superficial que la celulitis, que se presenta como una placa indurada, de bordes ligeramente sobreelevados, de color rojo brillante, con el aspecto típico de "piel de naranja", dolorosa y caliente. La fiebre y los escalofríos son muy comunes y preceden a la lesión local. Ciertos trastornos, como la obstrucción venosa o linfática, la paraparesia, el síndrome nefrótico, el síndrome de Klippel-Trénaunay, la diabetes mellitus y el alcoholismo, predisponen a la aparición de erisipela. INFECCIONES NECROSANTES Bajo este nombre se incluyen una gran variedad de infecciones cutáneas que tienen en común una progresiva inflamación y necrosis de la piel, el tejido celular subcutáneo, la fascia profunda e incluso el músculo. Clásicamente se han diferenciado, según sus características clínicas particulares, como afecciones específicas (fascitis necrosante, celulitis sinérgica necrosante, miositis clostridiana...). Sin embargo, esta clasificación es difícil de hacer por la similitud en la presentación clínica de los cuadros, y además no influye en el tratamiento inicial del paciente. Desde el punto de vista práctico, más que la identificación de estos procesos específicos lo que realmente interesa es determinar precozmente, por la gravedad que entrañan, la extensión de la lesión, las estructuras afectadas y el grado de afectación general. La radiografía simple, la ecografía, la gammagrafía y sobre todo la tomografía computarizada y la resonancia magnética son de gran utilidad diagnóstica (6). Pero, sin lugar a dudas, la exploración quirúrgica con la simple introducción de un dedo o un estilete a través de una pequeña incisión cutánea es el mejor método para conocer la profundidad y la extensión de las lesiones (7, 8). Las alteraciones en el hemograma y en la bioquímica sérica son inespecíficas; no obstante, la elevación de la proteína C reactiva, la creatinfosfocinasa y la calcemia se han relacionado con estos procesos necrosantes (7). Fascitis necrosante Es un término que agrupa a todos los procesos difusos de los tejidos blandos asociados a necrosis, en los cuales no hay afectación de la fascia profunda ni del músculo. Inicialmente es una infección localizada en la fascia superficial o el tejido celular subcutáneo, que se extiende ampliamente entre este plano y el músculo, diseminándose posteriormente hacia el exterior. Por esta razón, al principio, las manifestaciones cutáneas pueden estar ausentes o ser tan poco intensas que pasen desapercibidas, siendo determinante un alto índice de sospecha para el diagnóstico. La extensión del edema más allá de la zona del eritema, la presencia de vesículas cutáneas y de crepitación, y la ausencia de linfangitis y linfadenitis en pacientes con importantes enfermedades de base, nos harán pensar en una fascitis necrosante (9, 10). Posteriormente, el área lesionada se vuelve eritematosa, brillante, tumefacta, de consistencia leñosa, caliente y dolorosa, si bien con la destrucción de la inervación aparece anestesia. Más adelante la piel toma un color oscuro y surgen ampollas de contenido sanioso. La toxicidad sistémica es importante y la fiebre elevada. Se localiza primordialmente en las extremidades inferiores, el abdomen y el periné. Su etiología es polimicrobiana, con participación de bacilos gramnegativos aerobios y anaerobios (1, 7). Distintas enfermedades, hoy consideradas como fascitis necrosantes, han recibido nombres específicos. Una de ellas es la "celulitis sinérgica necrosante", "úlcera crónica" o "gangrena sinérgica progresiva", que resulta de la sinergia de estreptococos no hemolíticos microaerófilos y de S. aureus o de bacilos gramnegativos aerobios o facultativos. Se presenta como una úlcera con un área necrótica central, una zona violácea circundante y otra eritematosa e indurada más periférica, muy dolorosa, localizada principalmente en la pared torácica o abdominal. Surge sobre pequeños traumatismos o heridas quirúrgicas (11). Otra forma de fascitis necrosante es la "gangrena estreptocócica hemolítica de Meleney" o "celulitis necrosante monomicrobiana". Está causada por S. pyogenes y suele asentar sobre territorios dañados previamente. Se caracteriza por una zona eritematosa, con edema y dolor progresivo, que a los dos o tres días se oscurece hasta alcanzar un tinte cianótico y aparecen vesículas de contenido líquido amarillento o pardo oscuro. La lesión se extiende en profundidad por el plano interfascial, creando amplias zonas de necrosis. La toxicidad sistémica, incluso en forma de "shock" tóxico, es muy frecuente (1, 12). En las dos últimas décadas la frecuencia de esta infección parece haber aumentado (1,5 a 3,3 episodios por 100.000 habitantes según el Center for Diseases Control), e incluso se han descrito varios brotes que han sembrado la alarma en la sociedad (3). La "gangrena de Fournier", "gangrena idiopática del escroto" o "flemón perianal", es una variante más de fascitis que se localiza en el periné y los genitales. El origen suele hallarse en una infección vecina o en un traumatismo en pacientes con enfermedades de base (13, 14). A este grupo también pertenece la denominada "celulitis necrosante sinérgica gramnegativa", que es una infección mixta por anaerobios y enterobacterias caracterizada por un curso subagudo y la producción de un amplio edema y abundante gas (15). Mionecrosis clostridiana La mionecrosis clostridiana o gangrena gaseosa está causada en el 80% a 90% de las ocasiones por Clostridium perfringens y en menor medida por Clostridium novyi, Clostridium septicum y otras especies de Clostridium. Es una infección muscular tóxica y fulminante, que suele tener su origen en heridas profundas con gran destrucción tisular y muy sucias, contaminadas con tierra o cuerpos extraños con esporas de clostridios. También es frecuente tras la cirugía del colon y de la vía biliar. Se inicia con un dolor local intenso y progresivo. Aparece un exudado serosanguinolento de olor nauseabundo de marcado carácter dulzón, que a la tinción de Gram muestra abundantes bacilos y escasos polimorfonucleares. Los músculos están pálidos, carecen de elasticidad y contractilidad, y no sangran al corte. En la vecindad de la herida la piel se torna de color bronce amarillento, aparecen flictenas de contenido sanioso y es posible palpar la crepitación. Las manifestaciones sistémicas, causadas por exotoxinas, con "shock" y fallo cardiaco, respiratorio y renal, aparecen desde el principio del cuadro (4, 7). Miositis y mionecrosis no clostridianas La mionecrosis estreptocócica anaerobia es un cuadro clínico parecido a la gangrena gaseosa, pero de curso menos agudo y fulminante, producido por estreptococos anaerobios, aunque pueden asociarse otros estreptococos como los del grupo A y S. aureus. La mionecrosis anaerobia sinérgica es una celulitis sinérgica necrosante que se ha extendido al músculo. La gangrena vascular infectada se refiere a territorios isquémicos infectados por distintos microorganismos (cocos grampositivos y bacilos gramnegativos aerobios y anaerobios). Es frecuente encontrarla en las extremidades inferiores de los diabéticos. La mionecrosis por Aeromonas hydrophila se origina como consecuencia de traumatismos ocurridos en medio acuático de aguas dulces o relacionados con peces u otros animales de este hábitat. INFECCIONES SECUNDARIAS A LESIONES PREVIAS Infecciones por mordeduras Las mordeduras de animales suelen afectar a las extremidades, causando una celulitis con linfangitis, que por contigüidad puede extenderse a los tejidos de la vecindad (artritis, osteomielitis, etc.) y por vía sanguínea ocasionar una bacteriemia e infecciones de localizaciones distantes (endocarditis, meningitis, etc.). Habrá que distinguirlas de las humanas, ya que la etiología es distinta. En las primeras encontramos flora bucal del animal, aerobia de la boca (Streptococcus spp.) y anaerobia (Peptostreptococcus, Prevotella, Porphyromonas, Fusobacterium y Leptotrichia) y S. aureus. En las mordeduras de gato es muy frecuente encontrar P. multocida, y en las de rata Clostridium tetani, Leptospira spp., Francisella tularensis, Spirillum minus y Streptobacillus moniliformis, causantes de la fiebre por mordedura de este roedor (16). Las infecciones por mordeduras humanas están producidas por la flora bucal aerobia y anaerobia, S. aureus y E. corrodens, y en menor medida por Actinomyces spp. (17). Infecciones de herida quirúrgica La infección de una herida quirúrgica es una de las principales complicaciones de la cirugía y una de las infecciones nosocomiales más prevalentes (18, 19). Su desarrollo está en relación directa con el grado de contaminación microbiana que se produce en la intervención (20). Los microorganismos causales proceden de la flora del paciente, con las variaciones esperadas según la región anatómica involucrada, o del exterior (personal sanitario, material e instrumental empleado o del medio ambiente). Los patógenos hallados con mayor frecuencia son los de la piel, como S. aureus y S. epidermidis, y los intestinales como enterobacterias, Enterococcus faecalis y anaerobios, junto con P. aeruginosa y Streptococcus spp. (19). La exploración minuciosa de la herida, incluso con la ayuda de un estilete, es fundamental en el diagnóstico clínico de la infección, pero se puede confundir con el dolor y los demás signos inflamatorios locales del trauma quirúrgico y la fiebre no infecciosa por la reabsorción de hematomas, reacciones a medicamentos, embolia pulmonar, etc. No obstante, las manifestaciones del proceso séptico suelen comenzar 48 a 72 horas después de la intervención, e incluso semanas más tarde cuando se ha colocado material protésico, con la excepción de las infecciones por S. pyogenes o Clostridium spp., que aparecen en los primeros dos días con toxicidad sistémica. Es muy conveniente establecer la profundidad del proceso. En las infecciones superficiales el dolor, la tumefacción de los bordes y la secreción purulenta son los signos más evidentes. En la infección profunda, la dehiscencia de la sutura con aparición de esta clase de secreción suele ser muy sugestiva. Las manifestaciones generales, como fiebre, malestar general, etc., pueden estar presentes en cualquier tipo de infección, aunque son más frecuentes en las profundas o cuando un órgano o una cavidad están afectados (20). Infecciones asociadas a úlceras por presión Las úlceras por presión son consecuencia de las necrosis de los tejidos blandos que se producen por la compresión prolongada de los vasos sanguíneos y linfáticos entre una prominencia ósea y una superficie externa. Aparecen en ancianos y pacientes inmovilizados, y se localizan, sobre todo, en el área sacrocoxígea, los talones y los codos; constituyen una de las complicaciones más temidas en estos pacientes por su morbilidad y la posibilidad de sepsis (21). Se caracterizan por ser muy susceptibles a la contaminación bacteriana y posterior infección, que en las de la zona sacra y los talones suele ser polimicrobiana, con participación de cocos grampositivos y bacilos gramnegativos aerobios y anaerobios, probablemente procedentes de la flora fecal (4). Infecciones en el pie del diabético Son una de las complicaciones más frecuentes en los diabéticos y el primer motivo de hospitalización de estos enfermos, con estancias muy prolongadas, así como la principal causa de amputación no traumática. Existen muchos factores predisponentes, de los cuales los más importantes son la neuropatía y la vasculopatía. Como en las úlceras por presión, son infecciones mixtas producidas por cocos grampositivos y bacilos gramnegativos aerobios y anaerobios. En las superficiales predominan los grampositivos (S. aureus y Streptococcus spp.), mientras que en las más profundas, que amenazan la supervivencia del miembro, se añaden bacilos gramnegativos (enterobacterias y P. aeruginosa) y anaerobios (Streptococcus spp., Peptostreptococcus y Bacteroides del grupo fragilis) (21). TRATAMIENTO La hospitalización de los pacientes con infecciones de la piel y los tejidos blandos debe hacerse siempre que exista amenaza para la vida o la supervivencia del miembro afectado, necrosis o repercusión sistémica. También es conveniente en enfermos con procesos de base que puedan desestabilizarse o por razones de tipo psicosocial (22, 23). La cirugía precoz, con amplios desbridamientos, está indicada cuando hay lesiones necróticas, resultando determinante para el pronóstico (4, 24). El uso de oxígeno hiperbárico se ha mostrado eficaz en la mionecrosis clostridiana, pero su beneficio no está tan claro en otras infecciones necrosantes (8, 25). El tratamiento antimicrobiano es inicialmente empírico, dando cobertura a los microorganismos que normalmente habitan el área afectada, diferenciando la subdiafragmática de la que está por encima, o la cara de la mano o de las extremidades inferiores. También deberá actuar sobre los posibles contaminantes, como algunas especies del género Clostridium. Se puede hacer monoterapia con las asociaciones de una penicilina y un inhibidor de betalactamasas (amoxicilina-ácido clavulánico, ampicilina-sulbactam o piperacilina-tazobactam), un carbapenémico (imipenem-cilastatina o meropenem) o una cefamicina (cefoxitina o cefminox). Todos estos agentes son activos frente a Streptococcus spp., S. aureus sensible a la meticilina y los microorganismos causantes de las infecciones por mordeduras, pero difieren con respecto al enterococo (penicilinas asociadas a inhibidores de betalactamasas y carbapenémicos), a las enterobacterias (piperacilina-tazobactam y los carbapenémicos son los de mayor cobertura, mientras que las demás penicilinas tienen un espectro algo más reducido frente a ellas) y Pseudomonas spp. (piperacilina-tazobactam o un carbapenémico). Otra alternativa para el tratamiento empírico inicial es la terapia combinada: - Clindamicina más un aminoglucósido, aztreonam o una fluoroquinolona de segunda generación. - Cloxacilina, una cefalosporina de primera generación o un glucopéptido (en caso de Staphylococcus resistente a la meticilina) con un aminoglucósido o aztreonam más un nitroimidazol. - Una cefalosporina de segunda a cuarta generación o una fluoroquinolona de tercera generación más un nitroimidazol (3, 4). La administración intravenosa de los antibióticos se recomienda inicialmente en los casos graves, pudiendo pasar a la vía oral cuando mejoren. La vía oral es posible desde el principio en los cuadros leves a moderados (22, 23), y disponemos de varios antibióticos para hacerlo (Tabla 1). La cloxacilina tiene su indicación principal en las infecciones por estafilococos sensibles a la meticilina, ya que es diez veces menos activa que la penicilina sobre los estreptococos y carece de acción sobre Enterococcus spp., bacilos gramnegativos y anaerobios. Este estrecho espectro, la baja biodisponibilidad oral (del 50% al 70%), que se reduce con los alimentos, y su corta hemivida (30 minutos) limitan su uso empírico por vía oral. Amoxicilina-ácido clavulánico y ampicilina-sulbactam, por su espectro (grampositivos y gramnegativos aerobios y anaerobios) pueden ser considerados los agentes de elección, aunque la falta de cobertura frente a algunas enterobacterias y P. aeruginosa, y la intolerancia digestiva, en ocasiones, condicionan su empleo. La clindamicina es útil en infecciones por grampositivos y anaerobios, excepto en las ocasionadas por estafilococos resistentes a la meticilina, enterococos y el 25% de Bacteroides del grupo fragilis. Con ella, sola o asociada a pencilina, se han obtenido mejores respuestas en infecciones por microorganismos productores de toxinas (S. pyogenes y Clostridium spp.) debido a su efecto inmunomodulador y a que no está influida por el efecto inóculo ni por la fase de crecimiento bacteriano (23, 26).
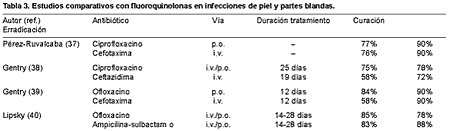
Las fluoroquinolonas han ido ganando terreno en esta indicación por su amplio espectro, las buenas concentraciones que alcanzan en los tejidos blandos, su tolerabilidad y la posibilidad de administración intravenosa y oral. Una de sus aportaciones más relevantes ha sido la posibilidad de tratar, por primera vez, infecciones graves por vía oral debido a su elevada biodisponibilidad, que en los casos de ofloxacino y levofloxacino se acerca al 100% (27, 28). La mayor experiencia se tiene con ciprofloxacino y ofloxacino, alcanzando, en estudios no comparativos y comparativos (29-40), excelentes resultados, incluido el pie del diabético (Tablas 2 y 3). Las modernas fluoroquinolonas de tercera y cuarta generación, por su mayor actividad sobre cocos grampositivos (Streptococcus spp. y S. aureus sensibles a meticilina), y en el caso de las de cuarta generación también frente a anaerobios, tienen un perfil más idóneo. En nuestro país, para uso oral y parenteral sólo disponemos de levofloxacino, que en Estados Unidos fue aprobado por la FDA para el tratamiento de las infecciones complicadas de la piel en dosis única de 750 mg/día. En dos trabajos, llevados a cabo en infecciones de la piel, se han comparado levofloxacino y ciprofloxacino por vía oral, consiguiendo tasas de curación clínica y erradicación microbiana similares, con la ventaja de la dosis única diaria de levofloxacino frente a la de cada doce horas de ciprofloxacino (Tabla 4) (41, 42). Todos estos trabajos demuestran la utilidad y seguridad de las quinolonas en las infecciones de piel y partes blandas, que incluso administradas por vía oral se han mostrado tan eficaces como las cefalosporinas de tercera generación por vía intravenosa (37-39). La posibilidad de realizar terapia secuencial permite reducir la estancia hospitalaria y los costes económicos, y ofrecer una mayor calidad de vida a los pacientes, lo cual es particularmente interesante en tratamientos prolongados, como ocurre en las infecciones de los pies de los diabéticos (43). La buena tolerabilidad, las pocas interacciones medicamentosas y el respeto por la flora intestinal, en particular sobre Enterococcus spp. y anaerobios, de algunas de las fluoroquinolonas, son otros aspectos interesantes de esta familia de antimicrobianos.
BIBLIOGRAFÍA 1. Lewis, R.T. Necrotizing soft-tissue infections. Infect Dis Clin North Am 1992; 6: 693-703. 2. Loudon, I. Fascitis necrosante, gangrena hospitalaria y fagedeno. Lancet (ed. esp.) 1994; 1416-1419. 3. Gomis, M., Sánchez, B., Ferrández, A., Barberán, J. Infecciones de la piel y los tejidos blandos. Rev Esp Quimioterapia 1998; 11 (Supl. 3): 73-79. 4. File, T.M., Tan, J.S. Treatment of skin and soft-tissue infections. Am J Med 1995; 169 (Suppl. 5A): 27S-33S. 5. Dejani, A.S., Wannamaker, L.W. Experimental infections of the skin in the hamster simulating human impetigo. III. Interactions between staphylococci and group A streptococci. J Exp Med 1971; 134: 588-606. 6. Boultin, R.D., Brossmann, J., Sartoris, D.J., Reilly, D., Resnick, D. Update on imaging of orthopedic infections. Orthop Clin North Am 1998; 29: 41-66. 7. Chapnick, E.K., Abter, E.I. Necrotizing soft-tissue infections. Infect Dis Clin North Am 1996; 10: 835-855. 8. Sutherland, M.E., Meyer, A.A. Necrotizing soft-tissue infections. Surg Clin North Am 1994; 74: 591-607. 9. Wilson, B. Necrotizing fasciitis. Am Surg 1952; 18: 416. 10. Garau Alemany, J. Infecciones graves de la piel y tejidos blandos. Rev Clin Esp 1996; 196: 44-48. 11. Brewer, G.E., Meleney, F.L. Progressive gangrenous infection of the skin and subcutaneous tissues following operation for acute perforative appendicitis: A study of symbiosis. Ann Surg 1926; 84: 438-450. 12. Wolf, J.E., Rabinowitz, L.G. Streptococcal toxic shock-like syndrome. Arch Dermatol 1995; 13: 73-77. 13. Fournier, A.J. Clinical study of fulminanting gangrene of the penis. La Sem Medicale 1984; 4: 69-74. 14. Efem, S.E.E. The features and aetiology of Fournier's gangrene. Postgrad Med J 1994; 70: 568-571. 15. Stone, H.H., Martin, J.D. Synergistic necrotizing cellulitis. Ann J Surg 1972; 175: 702-711. 16. Wiggins, M.E., Akelman, E., Weiss, A.P. The management of dog bites and dog bite infections to the hand. Orthopedics 1994; 17: 617-629. 17. Bunzli, W.F., Wright, D.H., Hoang, A.T., Dhams, R.D., Haas, W.F., Rotschafer, J.C. Current management of human bites. Pharmacotherapy 1998; 18: 227-234. 18. Horan, T.C., Gaynes, R.P., Martone, W.J., Jarvis, W.R., Emori, T.G. CDC definitions of nosocomial surgical site infections, 1992: A modification of CDC definitions of surgical wound infections. Infect Control Hosp Epidemiol 1992; 13: 606-608. 19. Vaqué Rafart, J. y Grupo de Trabajo EPINE (Eds.). Evaluación de la prevalencia de las infecciones nosocomiales en los hospitales españoles 1990-1997. Sociedad Española de Medicina Preventiva, Salud Pública e Higiene, Madrid 1998. 20. Nichols, R.L. Surgical infections: Prevention and treatment 1965 to 1995. Am J Surg 1996; 172: 68-74. 21. Barberán, J., Gomis, M. Pie del diabético: Un camino hacia la amputación que puede evitarse. Enferm Infecc Microbiol Clin 1998; 16: 190-196. 22. Caputo, G.M., Cavanagh, P.R., Ulbrecht, J.S., Gibbons, G.W., Karchmer, A.W. Assessment and management of foot disease in patients with diabetes. N Engl J Med 1994; 331: 854-860. 23. Deery, H.G. Outpatient parenteral anti-infective therapy for skin and soft-tissue infections. Infect Dis Clin North Am 1998; 12: 935-949. 24. Bilton, D.B., Zibari, G.B., McMillan, R.W., Aultman, D.F., Dunn, G., McDonald, J.C. Agressive surgical management of necrotizing fascitis serves to decrease mortality. A retrospective study. Am Surg 1998; 64: 397-400. 25. Clark, L.A., Moon, R.E. Hyperbaric oxygen in the treatment of life-threatening soft-tissue infections. Respir Care Clin North Am 1999; 5: 203-219. 26. Bisno, A., Stevens, D. Streptococcal infections of skin and soft tissues. N Engl J Med 1996; 334: 240-245. 27. Wolfson, J.S., Hooper, D. Comparative pharmacokinetics of ofloxacin and ciprofloxacin. Am J Med 1989; 87 (Suppl. 6C): 31S-36S. 28. Davis, R., Bryson, H.M. Levofloxacin: A review of its antibacterial activity, pharmacokinetics and therapeutic efficacy. Drugs 1994; 47: 677-700. 29. Wood, M.J., Logan, M.N. Ciprofloxacin for soft tissue infections. J Antimicrob Chemother 1986; 18 (Suppl. D): 159-164. 30. Parish, L.C., Asper, R. Systemic treatment of cutaneous infections. A comparative study of ciprofloxacin and cefotaxime. Am J Med 1987; 82 (Suppl. 4A): 227-229. 31. Powers, R.D., Schwartz, R., Snow, R.M., Yarbrough, D.R. III. Ofloxacin versus cephalexin in the treatment of skin, skin structure, and soft tissue infections in adults. Clin Ther 1991; 13: 727-736. 32. Lipsky, B.A., Yarbrough, D.R., Walker, F.B., Powers, R.D., Morman, M.R. Ofloxacin versus cephalexin for treating skin and soft tissue infections. Int J Dermatol 1992; 31: 443-445. 33. Peterson, L.R., Lissack, L.M., Canter, K., Fasching, C.E., Clabots, C., Gerding, D.N. Therapy of lower extremity infections with ciprofloxacin in patients with diabetes mellitus, peripheral vascular disease, or both. Am J Med 1989; 86: 801-808. 34. Gentry, L.O., Rodríguez-Gómez, G. Ofloxacin treatment of difficult infections of skin and skin structure. Cutis 1993; 51: 55-58. 35. Clavel, S., Micheli, C., Orgiazzi, J. Pefloxacin in the treatment of infections in diabetic foot lesions. 3rd International Symposium on New Quinolones, Vancouver 1990. Eur J Clin Microbiol Infect Dis 1991; Special issue: 632-634. 36. Malanoski, G.J., Gibbons, G.W., Chrzan, J.S., Levin, E., Karchmer, A.W. Fleroxacin plus clindamycin in the treatment of limb-threatening foot infections in diabetic patients. Clin Drugs Invest 1995; 9 (Suppl. 1): 30-35. 37. Pérez-Ruvalcaba, J.A., Quintero-Pérez, N.P., Morales-Reyes, J.J., Huitrón-Ramírez, J.A., Rodríguez-Chagollán, J.J., Rodríguez-Noriega, E. Double-blind comparison of ciprofloxacin with cefotaxime in the treatment of skin and skin-structure infections. Am J Med 1987; 82 (Suppl. 4A): 242-246. 38. Gentry, L.O., Koshdel, A. Intravenous/oral ciprofloxacin versus intravenous ceftazidime in the treatment of serious Gram-negative infections of the skin and skin structure. Am J Med 1989; 87 (Suppl. 5A): 132S-135S. 39. Gentry, L.O., Rodríguez-Gómez, G., Zeluff, B.J., Khoshdel, A., Price, M. A comparative evaluation of oral ofloxacin versus intravenous cefotaxime therapy for serious skin and skin structure infections. Am J Med 1989; 87 (Suppl. 6C): 57S-60S. 40. Lipsky, B.A., Baker, P.D., Landon, G.C., Fernau, R. Antibiotic therapy for diabetic foot infections: Comparison of two parenteral to oral regimes. Clin Infect Dis 1997; 24: 643-648. 41. Nichols, R.L., Smith, J.W., Gentry, L.O. y cols. Multicenter randomized study comparing levofloxacin and ciprofloxacin for uncomplicated skin and skin structure infections. South Med J 1998; 90: 1193-2000. 42. Nicodemo, A.C., Robledo, J.A., Jasovich, A., Neto, W. A multicentre, double-blind, randomized study comparing the efficacy and safety of oral levofloxacin versus ciprofloxacin in the treatment of uncomplicated skin and skin structure infections. Int J Clin Pract 1998; 52: 69-74. 43. Gomis, M., Barberán, J., Sánchez, B., Ferrández, A. Repercusión económica de las infecciones en los pies de los diabéticos. Farmacoeconomía 1995; 4: 39-48.
|